O calculer le nombre de particules atomiques est utilisé pour indiquer la quantité de protons (dans le noyau), d'électrons (dans l'électrosphère) et de neutrons (dans le noyau) présents dans tout atome ou ion. Pour ce faire, il est indispensable de connaître quelques caractéristiques des atomes :
1- Numéro atomique (Z)
C'est un code mathématique, représenté par la lettre majuscule Z, positionné en bas à gauche de l'acronyme d'un atome :
ZX
Il indique le nombre de protons (p) dans le noyau et le nombre d'électrons (e) dans l'électrosphère d'un atome. Donc, en termes généraux :
Z = p = e
2- Numéro de masse (A)
C'est un code mathématique qui correspond à la somme du nombre de protons (p) et de neutrons (n), tous deux présents dans le noyau de n'importe quel atome. L'équation représentant le nombre de masse est donnée par :
A = p + n
Puisque le nombre de protons est égal au numéro atomique, nous pouvons écrire l'équation pour calculer le nombre de masse comme suit :
A = Z + n
Si nous connaissons le nombre de masse et le numéro atomique d'un atome, nous pouvons déterminer le nombre de neutrons comme suit :
n = A - Z
3- ions
Ce sont des atomes qui perdent ou gagnent des électrons. Ils ont un signe positif ou négatif positionné en haut à droite de leur représentation, comme dans le modèle suivant :
X+ ou X-
Ion positif: C'est ce qu'on appelle un cation et le signe positif indique qu'il a perdu des électrons.
Ion négatif: C'est ce qu'on appelle un anion et le signe négatif indique qu'il a gagné des électrons.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
4- Similitudes atomiques
a) Isotopes
Atomes qui ont le même numéro atomique et des nombres de masse différents. Exemple:
7X14 et 7Oui16
Les atomes X et Y ont le même numéro atomique (à gauche de l'acronyme), c'est-à-dire égal à 7. L'atome X a un nombre de masse (à droite de l'acronyme) égal à 14, et l'atome Y a un nombre de masse égal à 16.
b) Isobares
Atomes qui ont le même nombre de masse et des numéros atomiques différents. Exemple:
15X31 et 13Oui31
Les atomes X et Y ont un nombre de masse (à droite de l'acronyme) égal à 31. L'atome X, quant à lui, a un numéro atomique égal à 15 et l'atome Y a un numéro atomique égal à 13.
c) Isotones
Atomes qui ont des numéros de masse et des numéros atomiques différents, mais le même nombre de neutrons.
d) Isoélectronique
Atomes qui ont le même nombre d'électrons. Exemple:
12X+2 et 7Oui-3
L'atome X a un numéro atomique égal à 12 et est un cation (avec une charge positive +2), il perd donc deux électrons, ayant ainsi 10 électrons dans son électrosphère. L'atome Y, quant à lui, a un numéro atomique égal à 7 et est un anion (avec une charge négative -3), il gagne donc trois électrons, ayant ainsi 10 électrons dans son électrosphère.
Carte mentale: particules atomiques
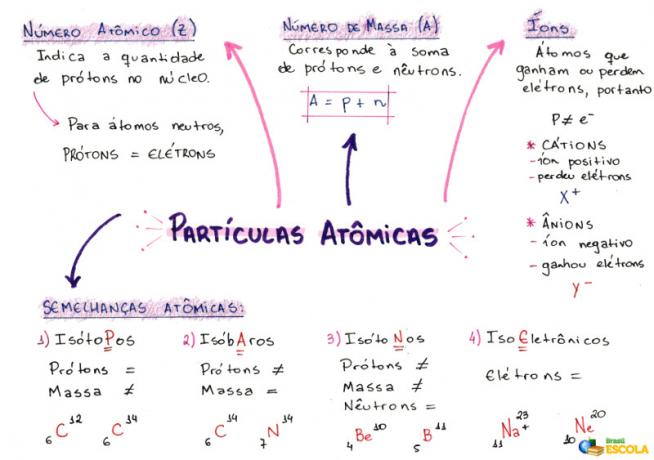
* Pour télécharger la carte mentale en PDF, Cliquez ici!
Exemples de calcul du nombre de particules atomiques
Exemple 1: Déterminer le nombre de protons, de neutrons et d'électrons dans l'atome 14X29.
Les valeurs suivantes pour l'atome X ont été données :
Numéro de messe (en haut à droite) = 29
Numéro atomique (en bas à gauche) = 14
Pour déterminer le nombre de protons :
Le nombre de protons est toujours égal au numéro atomique, donc l'atome X a 14 protons.
Pour déterminer le nombre d'électrons :
Comme l'atome X n'est pas un ion, le nombre d'électrons est donc égal au nombre de protons, soit 14.
Pour déterminer le nombre de neutrons :
Le nombre de neutrons est déterminé en utilisant le nombre de masse et de protons dans la formule suivante :
A = p + n
29 = 14 + n
29 - 14 = n
n = 15
Exemple 2 : Déterminer le nombre de protons, de neutrons et d'électrons de l'ion X+3, sachant que leur nombre de masse et leur numéro atomique sont respectivement 51 et 23.
Les valeurs suivantes pour l'ion X ont été données :
Nombre de masse = 51
Numéro atomique (en bas à gauche) = 23
Pour déterminer le nombre de protons :
Le nombre de protons est toujours égal au numéro atomique, donc l'atome X a 23 protons.
Pour déterminer le nombre d'électrons :
L'ion X est positif (+3), c'est donc un cation qui a perdu trois électrons. Son nombre d'électrons est donc de 20.
REMARQUE: La réduction ou l'augmentation du nombre d'électrons se produit toujours par rapport au numéro atomique.
Pour déterminer le nombre de neutrons :
Le nombre de neutrons est déterminé en utilisant le nombre de masse et de protons dans la formule suivante :
A = p + n
51 = 23 + n
51 - 23 = n
n = 28
Exemple 3 : Un atome W a un numéro atomique et une masse égaux à, respectivement, 29 et 57, étant isobare d'un l'atome Y, qui a un numéro atomique égal à 30, qui est l'isotope d'un atome B, dont le nombre de masse est 65. Avec cette information, déterminez le nombre de protons, de neutrons et d'électrons dans l'atome B.
Données fournies par l'exercice :
Atome W
numéro atomique (en bas à gauche) = 29
nombre de masse (en haut à droite) = 57
Y isobar, c'est-à-dire que la masse de Y est également de 57.
atome Y
numéro atomique = 30
nombre de masse = 57
Avec ces deux valeurs, il faut déterminer son nombre de neutrons car c'est l'isotone de l'élément B :
A = Z + n
57 = 30 + n
57 - 30 = n
n = 27
Une tombe:
nombre de masse = 65
nombre de neutrons = 27
Avec ces données, nous devons déterminer son numéro atomique, car avec cela, nous déterminerons son nombre de protons et son nombre d'électrons (puisque ce n'est pas un ion) :
A = Z + n
65 = Z +27
65 - 27 = Z
Z = 38
Par conséquent, l'atome B a 38 protons, 38 électrons et 27 neutrons.
* Carte mentale de Victor Ricardo Ferreira
Professeur de chimie
Par moi Diogo Lopes Dias


