LES D'abordDroitdonneThermodynamique est une application de principedonnepréservationdonneénergie pour les systèmes thermodynamiques. Selon cette loi, la variation de énergie interne d'un système thermodynamique est la différence entre la quantité de Chauffer absorbé par le système et le travail qu'il accomplit.
Voirégalement:Concepts fondamentaux et résumé de la Thermologie
Quelle est la première loi de la thermodynamique ?
La première loi de la thermodynamique est une conséquence directe du principe de conservation de l'énergie. Selon ce principe, l'énergie totale d'un systèmereste toujours constant, puisqu'elle n'est pas perdue, mais transformée.
Dans le cadre de Thermodynamique, sont utilisés notions plus précises et moins génériques que ceux utilisés dans le principe de conservation de l'énergie. Dans la première loi de la thermodynamique, nous utilisons des concepts tels que énergieinterne,Chauffer et travail, qui sont pertinents pour le champ d'application de Machines thermiques (applications technologiques d'importance fondamentale pour la thermodynamique).

Imaginez une machine à vapeur, lorsque le fluide de travail de cette machine (la vapeur d'eau) reçoit de la chaleur d'une source externe, deux conversions d'énergie sont possibles: la vapeur peut avoir sa propre Température augmenté de quelques degrés ou, même, il peut développer et déplacer les pistons de cette machine, effectuant ainsi une certaine quantité de travail.
"La variation de l'énergie interne d'un système thermodynamique correspond à la différence entre la quantité de chaleur absorbée par celui-ci et la quantité de travail que ce système effectue."
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Formule de la première loi de la thermodynamique
La formule utilisée pour décrire mathématiquement la première loi de la thermodynamique est illustrée ci-dessous :

U – variation d’énergie interne (cal ou J)
Q – chaleur (chaux ou J)
τ – travail (chaux ou J)
Pour utiliser cette formule, nous devons prêter attention à certaines règles de signal :
U – sera positif si la température du système augmente ;
U – sera négatif si la température du système diminue ;
Q – sera positif si le système absorbe la chaleur de l'environnement extérieur ;
Q – il sera négatif, si le système cède de la chaleur à l'environnement extérieur ;
τ – ce sera positif si le système se développe, en effectuant des travaux sur l'environnement extérieur;
τ – il sera négatif si le système se contracte, recevant du travail de l'environnement externe.
variation d'énergie interne
Le terme ΔU fait référence au changement d'énergie attribué au énergie cinétique des particules constitutives du système, dans le cas d'un gaz parfait, on peut dire que ΔU est équivalent à :
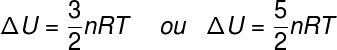
non – nombre de moles (mol)
R – constante universelle des gaz parfaits (0,082 atm.l/mol. K ou 8,31 J/mol. K)
T – température absolue (kelvin)
En analysant les formules, on peut voir que, s'il n'y a pas de changement de température dans le système, son énergie interne restera également inchangé. Par ailleurs, il est important de dire que pour les machines thermiques, qui fonctionnent par cycles, la variation de l'énergie interne, à la fin de chaque cycle, doit être nulle, car à ce moment-là, le moteur recommence à fonctionner avec la température initiale.
Voirégalement:Performances des machines thermiques: comment sont-elles calculées ?
Chaleur
Passant au terme suivant, Q, qui fait référence à la quantité de chaleur transférée au système, nous utilisons généralement le équation fondamentale de la calorimétrie, indiqué ci-dessous:
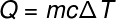
Q -chaleur (chaux ou J)
m – masse (g ou kg)
ç – chaleur spécifique (cal/gºC ou J/kg. K)
T – variation de température (celsius ou kelvin)
Travail
La dernière des quantités liées à la première loi de la thermodynamique est le travail (τ), qui a un formule analytique uniquement pour les transformations qui se produisent sous pression constante, également connue aimer transformations isobares, Regardez:
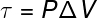
P – pression (Pa ou atm)
V – variation de volume (m³ ou l)
Lorsque la pression exercée sur le système n'est pas constante, le travail peut être calculé par l'aire du graphique de la pression en fonction du volume (P x V). Pour en savoir plus sur cette magnitude scalaire, visitez: travail.
exercices résolus
Question 1)(CéfetMG) Le travail effectué dans un cycle thermique fermé est égal à 100 J, et la chaleur impliquée dans les échanges thermiques est égale à 1000 J et 900 J, respectivement, avec des sources chaudes et froides.
De la première loi de la thermodynamique, la variation de l'énergie interne dans ce cycle thermique, en joules, est
a) 0
b) 100
c) 800
d) 900
e) 1000
Résolution
Alternative a.
Résolvons l'exercice en utilisant la première loi de la thermodynamique, notez :

Selon l'énoncé, on nous demande de calculer la variation de l'énergie interne dans un cycle thermodynamique fermé, auquel cas nous savons que le la variation d'énergie interne doit être nulle, car la machine reviendra à fonctionner à la même température qu'au début du cycle.
Question 2)(Upf) Un échantillon d'un gaz parfait se dilate en doublant son volume lors d'une transformation isobare et adiabatique. Considérant que la pression subie par le gaz est de 5.106 Pa et son volume initial 2.10-5 m³, on peut dire :
a) La chaleur absorbée par le gaz pendant le processus est de 25 cal.
b) Le travail fourni par le gaz lors de sa détente est de 100 cal.
c) La variation d'énergie interne du gaz est de –100 J.
d) La température du gaz reste constante.
e) Aucune des réponses ci-dessus.
Résolution
Alternative c.
En utilisant les informations fournies par l'énoncé de l'exercice, nous utiliserons la première loi de la thermodynamique pour trouver la bonne alternative :
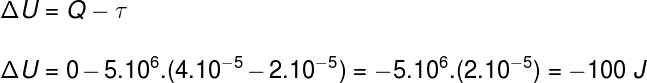
Question 3)(Wow) Un bidon de cuisine contient du gaz à haute pression. Lorsque nous ouvrons cette bouteille, nous remarquons que le gaz s'échappe rapidement dans l'atmosphère. Comme ce processus est très rapide, on peut le considérer comme un processus adiabatique.
Considérant que la première loi de la thermodynamique est donnée par ΔU = Q - W, où ΔU est le changement d'énergie à l'intérieur du gaz, Q est l'énergie transférée sous forme de chaleur et W est le travail effectué par le gaz, c'est correct déclarer que :
a) La pression du gaz a augmenté et la température a diminué.
b) Le travail effectué par le gaz était positif et la température du gaz n'a pas changé.
c) Le travail effectué par le gaz était positif et la température du gaz diminuait.
d) La pression du gaz a augmenté et le travail effectué était négatif.
Résolution
Alternative c.
Une fois que le volume de gaz s'est dilaté, on dit que le travail effectué était positif, c'est-à-dire que le gaz lui-même a effectué un travail sur l'environnement extérieur. De plus, comme le processus se déroule très rapidement, le gaz n'a pas le temps d'échanger de la chaleur avec l'environnement, ce qui suit :
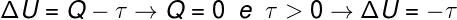
Selon le calcul, l'énergie interne du gaz diminue d'une quantité égale au travail effectué par le gaz, de plus, puisqu'il y a une diminution de l'énergie interne du gaz, il y a aussi une diminution de Température.
Question 4)(Udesc) Dans un laboratoire de physique, des expériences sont réalisées avec un gaz qui, à des fins d'analyse thermodynamique, peut être considéré comme un gaz parfait. De l'analyse de l'une des expériences, dans laquelle le gaz a été soumis à un processus thermodynamique, il a été conclu que toute la chaleur fournie au gaz était convertie en travail.
Cochez l'alternative qui représente correctement le processus thermodynamique effectué dans l'expérience.
a) processus isovolumétrique
b) processus isotherme
c) processus isobare
d) processus adiabatique
e) procédé composite: isobare et isovolumétrique
Résolution
Alternative b.
Pour que toute la chaleur fournie à un gaz soit convertie en travail, il ne doit y avoir aucune absorption d'énergie interne par en d'autres termes, le gaz doit passer par un processus isotherme, c'est-à-dire un processus qui se déroule à température constant.
Par Rafael Hellerbrock
Professeur de physique


