Éther c'est une fonction organique oxygénée, c'est-à-dire qu'elle possède l'élément chimique oxygène, en plus du carbone et de l'hydrogène. Cette fonction a pour principale caractéristique structurelle la présence de deux radicaux organiques attaché à un atome d'oxygène.
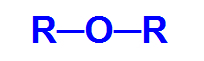
Formule développée générale d'un éther
Ainsi, la chaîne carbonée d'un éther est hétérogène et peut avoir deux radicaux identiques ou différents, soit alkyle, types de radicaux qui n'ont pas de structure aromatique, ou aryle, radicaux qui n'ont pas de structure aromatique.
Caractéristiques physiques de l'éther
Quant à l'état physique à température ambiante: lorsque le éther il a quatre atomes de carbone ou plus dans sa composition, il est liquide;
Quant au point de fusion et au point d'ébullition: par rapport à d'autres composés organiques de masse molaire approximative, ont un point de fusion similaire à celui des alcanes et inférieur à celui du reste des composés biologique;
Quant à la densité: ce sont des composés qui ont une faible densité par rapport à l'eau ;
Quant aux forces d'interaction: les éthers sont composés de faible polarité, interagissant les uns avec les autres par une faible interaction dipolaire permanente. Avec l'eau et les alcools, les éthers ont la capacité d'interagir par des liaisons hydrogène.
En ce qui concerne la polarité: sont des composés qui ont une géométrie angulaire, donc, ils sont polaires.
Quant à la caractéristique organoleptique: ce sont des substances qui dégagent une odeur très agréable, mais leur inhalation peut provoquer une dépendance.
Nomenclature officielle de l'éther
Préfixe du radical mineur + oxy + préfixe du radical majeur + infixe + o
Réaliser la nomenclature officielle d'un éther, Il est essentiel de déterminer quel est votre ligand majeur et quel est votre ligand mineur. Pour ce faire, suivez deux exemples d'application de cette règle de nommage ci-dessous :
1er exemple :
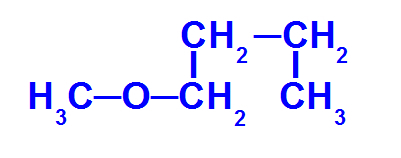
Formule développée d'un éther avec moins de carbones
L'éther ci-dessus a les radicaux suivants :
Méthyle (CH3-);
Butyle (CH3-CH2-CH2-CH2-).
Pour nommer ce composé, on a :
préfixe radical mineur: Met
+
oxy
+
préfixe du radical majeur: mais
+
an (car il n'a que des liens simples)
+
O
Alors, le nom de ce éther ce sera le méthoxybutane.
2e exemple :
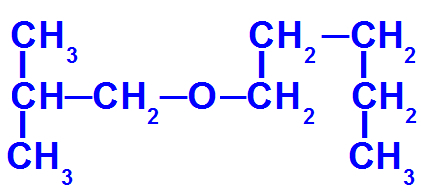
Formule développée d'un éther avec plus de carbones
Cet éther a les radicaux suivants :
Isobutyle [(CH3)2-CH-CH2-);
pentyle (CH3-CH2-CH2-CH2-CH2).
Pour le nommer, on a donc :
préfixe radical mineur: isobut
+
oxy
+
préfixe du radical majeur: pent
+
an (car il n'a que des liens simples)
+
O
Ainsi, le nom du éther en question sera l'isobutoxypentane.
Nomenclature habituelle de l'éther
Ether + nom des radicaux (le plus simple puis le plus complexe) + ico
ou alors
Noms radicaux + éther
Suivez ci-dessous deux exemples d'application de cette règle de nommage :
1er exemple :

Formule développée d'un éther qui a quatre carbones
Cette éther présente les radicaux suivants :
Méthyle (CH3);
Isopropyle (CH3-CH-CH3).
Donc, pour ce composé, on a :
Éther
+
radical mineur: méthyle
+
préfixe de radical majeur: isopropyle
+
je suis
Ainsi, le nom du éther il s'agira de l'éther méthylisopropylique, ou bien de l'éther méthylisopropylique.
2e exemple :

Formule développée d'un éther qui a cinq carbones
L'éther ci-dessus a les radicaux suivants :
Éthyl (CH3-CH2-);
Propyle (CH3-CH2-CH2-).
Pour nommer ce composé, on a :
Éther
+
radical mineur: éthyle
+
préfixe de radical majeur: propyle
+
je suis
Ainsi, le nom du éther il s'agira de l'éthyl propyl éther, qui peut aussi être de l'éthyl propyl éther.
Utilisations des éthers
En général, les éthers sont utilisés :
En tant que solvants organiques inertes, c'est-à-dire ne participant à aucune réaction ;
Utilisé dans l'extraction d'essences, telles que les fleurs, le bois, etc.
Utilisé dans l'extraction de diverses huiles et graisses.
Par moi Diogo Lopes
La source: École du Brésil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eter.htm
