Dans le texte "Électrolyse ignée”, il a été expliqué que ce processus se produit lorsqu'un courant électrique est passé dans une substance fondue (à l'état liquide), sans la présence de l'eau et, de cette façon, le cation reçoit des électrons et l'anion donne des électrons, de sorte que les deux ont une charge électrique égale à zéro et une énergie accumulé.
Pour mieux comprendre comment se produit l'électrolyse ignée, considérons l'un des exemples les plus importants de ce type de procédé, l'électrolyse du chlorure de sodium ou du sel de table (NaCl).
Le chlorure de sodium se forme dans la nature par le transfert d'un électron du sodium (Na) au chlore (Cl), selon la réaction ci-dessous :
2Na(s) + 1Cl2(g) → 2NaCl (s)

Ce processus est spontané, mais le processus inverse de cette réaction n'est pas spontané, c'est-à-dire la production de chlore gazeux (Cl2(g) – figure ci-dessous) et le sodium métallique (Na (s)) n'existe pas dans la nature. Si nous voulons que cela se produise, nous devrons lancer le processus.
Cela peut être fait par électrolyse ignée. Le sel est chauffé à une température supérieure à 800,4°C, qui est son point de fusion; et c'est ainsi qu'il se confond, passant du solide au liquide. Dans cet état physique, vos ions Na+ et Cl- sont libres.
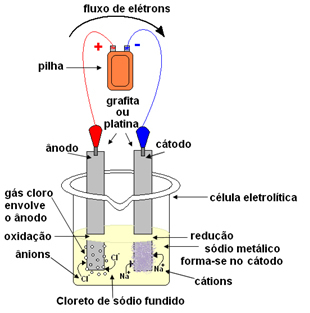
Le sel fondu est ensuite placé dans un récipient, la cuve d'électrolyse, et deux électrodes inertes de platine ou de graphite sont plongées dans le chlorure de sodium. Ces électrodes sont connectées à une source qui génère du courant électrique continu, telle qu'une batterie ou une cellule.
Avec le passage du courant électrique, il se passe ce qui suit :
- Le pôle négatif de la pile ou de la cellule fournit des électrons à l'une des électrodes, qui devient la cathode ;
- Cathode: reçoit les électrons de la cellule et devient le pôle négatif, attirant les cations Na.+, car les charges opposées s'attirent. Ces ions reçoivent les électrons de l'électrode (cathode) et leur réduction se produit, formant du sodium métallique :
Réduction:À+(ℓ) + et- → Dans(s)
Le sodium métallique se dépose au-dessus de l'électrode et est envoyé dans un réservoir.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
- Anode: devient chargé positivement, attirant les anions Cl- (c'est pourquoi on l'appelle une anode). Ces ions perdent leurs électrons au contact de l'anode et subissent donc une oxydation, formant des atomes de chlore, qui se combinent immédiatement deux à deux pour former du chlore gazeux :
Oxydation:2Cl-(ℓ) → 2 et- + 1Cl2(g)
Ce gaz bouillonne autour de l'anode et est collecté par un tube en verre adapté au système.
Ainsi, la réaction globale qui se produit dans ce cas est donnée par :
Cathode: 2Na+(ℓ) + 2e- → 2Na(s)
Anode: 2Cl-(ℓ) → 2 et- + 1Cl2(g) ____________
Réaction globale: 2Na+(ℓ) + 2Cl-(ℓ) → 2Na(s) + 1Cl2(g)
Un autre aspect important à prendre en compte, qui a été souligné à la fin du texte mentionné (électrolyse ignée), est que, pour l'électrolyse se produit, la cellule ou la batterie utilisée pour générer le courant électrique doit avoir un ddp (différence de potentiel) égal ou supérieur à la différence de potentiel du réaction.
Regardons cela dans le cas de l'électrolyse du chlorure de sodium que nous considérons. Pour trouver la différence de potentiel de cette réaction, il suffit de diminuer le potentiel de réduction standard de la cathode par celui de l'anode. Ceci est expliqué dans le texte. Différence de potentiel d'une batterie .
Grâce au tableau des potentiels de réduction standard (E0rouge), on sait que :
À+(ℓ) + et- → Dans(s) ET0rouge= -2,71
2Cl-(ℓ) → 2 et- + 1Cl2(g) ET0rouge= +1,36
Maintenant, il suffit de diminuer ces valeurs pour connaître la différence de potentiel de la réaction globale :
Et0 = ET0rouge (cathode) - ET0rouge (anode)
Et0 = -2,71 – (+ 1,36)
Et0 = - 4,07 V
Par conséquent, cela signifie que la cellule ou la batterie qui sera utilisée doit avoir une tension égale ou supérieure à 4,07V pour effectuer l'électrolyse ignée du chlorure de sodium.
La valeur négative indique seulement qu'il s'agit d'un processus non spontané.. Dans le cas des batteries, qui est un processus spontané, la valeur de la force électromotrice (∆E0) donne toujours positif.
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Electrolyse du chlorure de sodium igné »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/eletrolise-Ignea-cloreto-sodio.htm. Consulté le 28 juin 2021.
e) C'est un processus redox spontané.
Chimie

Applications de l'électrolyse, de la galvanoplastie, du nickelage, du chromage, du nickel, du chrome, de la cathode, du sodium, de l'aluminium, du chlore, soude caustique, hydrogène gazeux, électrolyse ignée, électrolyse aqueuse, métaux alcalins, alcalino-terreux, gaz chlore.
Chimie

Electrolyse, solutions électrolytiques, courant électrique, réactions d'oxydo-réduction, processus chimique spontané, processus chimique non spontané, transformateur, transformation artificielle, industries, métaux alcalins, alcalino-terreux, hydrogène gazeux, gaz cl



