Jusqu'en 1824, on croyait que les machines thermiques construites pouvaient subir un parfait, c'est-à-dire qu'on pensait qu'ils pourraient atteindre un rendement de 100 %, ou quelque chose d'approchant valeur. En d'autres termes, les scientifiques de l'époque pensaient pouvoir utiliser toute l'énergie thermique fourni à ces machines - c'est-à-dire qu'ils pensaient pouvoir transformer toute cette énergie en travail.
L'ingénieur Sadi Carnot était chargé, à l'époque, de faire des démonstrations dans lesquelles il était impossible d'obtenir 100 % de rendement. Sadi a proposé qu'une machine thermique théorique idéale fonctionnerait à travers un cycle particulier, maintenant appelé Cycle Carnot.
Dans sa démonstration, Carnot a conceptualisé deux postulats, qui ont été proposés avant même que la première loi de la thermodynamique ne soit énoncée. Voyez ce qu'énoncent les postulats de Carnot :
1er postulat de Carnot
- Aucune machine fonctionnant entre deux températures fixes ne peut produire plus que la machine idéale de Carnot fonctionnant entre ces mêmes températures.
2e postulat de Carnot
- Lorsqu'elle fonctionne entre deux températures, la machine idéal de Carnot a le même rendement, quel que soit le fluide de service, et est totalement réversible, sans ajouter d'énergie.
D'après les postulats énoncés par Carnot, on voit la garantie que le rendement d'un moteur thermique est fonction des températures des sources chaudes et froides. Or, en fixant les températures de ces sources, la machine théorique de Carnot est celle qui parvient à avoir le rendement le plus élevé.
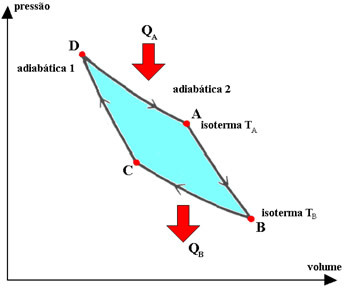
Le cycle de Carnot est un cycle idéalisé et réversible, dans lequel le fluide de fonctionnement est un gaz parfait, ce qui correspond à deux transformations. isothermes c'est deux adiabatique, entrecoupé. Les processus décrits par le gaz dans ce cycle sont :
1.°) expansion isotherme DA, pendant laquelle le gaz est en contact avec le système à température constante TA (source chaude), recevant de celui-ci une quantité de chaleur QA.
2.°) expansion adiabatique AB, pendant laquelle il n'y a pas d'échange de chaleur avec l'environnement. Le système effectue un travail avec une diminution de l'énergie interne et, par conséquent, de la température.
3.°) BC contraction isotherme, pendant laquelle le gaz est en contact avec le système à température constante TB (source froide), lui conférant une quantité de chaleur QB.
4.°) CD contraction adiabatique, pendant laquelle le gaz n'échange pas de chaleur avec l'environnement. Le système reçoit du travail, qui sert à augmenter son énergie interne et donc sa température.
Dans le cycle de Carnot, la chaleur échangée (QLES et QB) et les températures thermodynamiques (TLES et TB) des sources chaudes et froides sont proportionnelles, la relation étant :

En substituant l'équation d'efficacité d'une machine thermique, on obtient, pour la machine de Carnot :
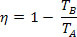
Compte tenu de la température de la source froide (TB) égal à zéro kelvin (zéro absolu), nous avons η = 1 ou η = 100 %. Cependant, ce fait contredit la deuxième loi de la thermodynamique, qui garantit qu'un revenu de 100%, ce qui nous amène à conclure qu'aucun système physique ne peut avoir une température égale à zéro absolu.
Par Domitiano Marques
Diplômé en Physique
La source: École du Brésil - https://brasilescola.uol.com.br/fisica/maquinas-carnot.htm


