Toi aldéhydes et le cétones ce sont des fonctions organiques très similaires. Tous deux ont dans leur structure la fonction carbonyle (C = O), à la seule différence que, dans le cas de aldéhydes, il apparaît toujours en bout de chaîne carbonée, c'est-à-dire que l'un des ligands carbonylés est le hydrogène; les cétones ont le carbonyle entre deux autres atomes de carbone.
Groupe fonctionnel aldéhydes :Groupe fonctionnel des cétones :
O O
║ ║
C C H C C C
Pour cette raison, il existe des cas d'isomérie fonctionnelle entre les aldéhydes et les cétones. Par exemple, ci-dessous, nous présentons deux isomères fonctionnels qui ont la même formule moléculaire (C3H6O), mais l'un est un aldéhyde (propanal) et l'autre est une cétone (propanone). Voyez comment cela change totalement leurs propriétés et leurs applications :
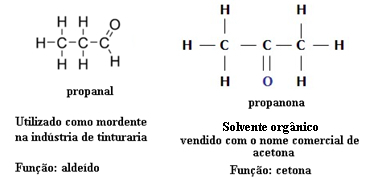
Exemple d'isomérie fonctionnelle entre aldéhyde et cétone
Imaginez que vous êtes dans un laboratoire et que vous trouvez un flacon avec un liquide incolore qui n'a que la formule moléculaire C3H6O. Que feriez-vous pour savoir s'il s'agit d'une cétone ou d'un aldéhyde ?
Pour résoudre des problèmes comme celui-ci, il existe des méthodes de différenciation des aldéhydes et des cétones basées sur la réaction de ces composés contre des agents oxydants faibles. Comme indiqué ci-dessous, face à des oxydants faibles, les aldéhydes réagissent en s'oxydant, tandis que les cétones ne réagissent pas. Nous disons queles aldéhydes agissent comme agents réducteurs, mais les cétones ne le font pas, ils ne réagissent comme agents réducteurs qu'au contact d'oxydants énergétiques.
Aldéhydes + Oxydants faibles → acide carboxylique
O O
║ ║
C C ─ H + [O] → C C ─ OH
Cétones + Oxydants faibles → Ne réagissent pas
O
║
C ─ C ─ C + [O] → Aucune réaction ne se produit
Sur cette base, il suffit alors d'effectuer cette réaction et de voir si le composé réagit ou non. S'il réagit, nous savons que c'est un aldéhyde; s'il ne réagit pas, c'est une cétone.
De plus, les produits formés dans ces réactions d'oxydation des aldéhydes sont bien visibles, avec des changements de couleur se produisant, comme cela sera montré plus loin.
Il existe trois méthodes principales pour différencier les aldéhydes et les cétones, à savoir :
1- Tollens réactifs : Ce réactif est un solution ammoniacale de nitrate d'argent, c'est à dire qu'elle contient du nitrate d'argent (AgNO3) et un excès d'hydroxyde d'ammonium (NH4OH):
AgNO3 + 3 NH4OH → Ag (NH3)OH + NH4AU3 + 2H2O
Tollens Reactive (du nom du chimiste allemand Bernhard Tollens (1841-1918))
Comme expliqué dans le texte Fabriquer un miroir en argent, lorsqu'un aldéhyde est mis en contact avec le réactif Tollens, il est oxydé en l'acide carboxylique correspondant, tandis que les ions argent sont réduits en Ag0 (argent métallique). Si cette réaction est effectuée, par exemple, dans un tube à essai, cet argent métallique se déposera sur les parois du tube, entraînant la formation d'un film appelé un miroir d'argent. Ce résultat observé est très beau et est utilisé dans le processus de fabrication des miroirs industriels.
La réaction qui a lieu peut être représentée comme suit :
O O
║ ║
R C H + H2O → R C ─ OH + 2e- + 2 H+
2 Ag+ + 2e- → 2 Ag0
2 NH3 + 2H+ → 2 NH4+
O O
║║
R C H + 2 Ag+ + 2 NH3 +H2O → R C OH + 2 Ag0 + 2 NH4+
aldéhyde Tollens réactifsacide carboxylique argent métallique (miroir argenté)
Par contre, si on fait réagir la cétone avec le réactif de Tollens, la formation d'argent métallique ne se produira pas, car les cétones ne peuvent pas réduire les ions Ag.+.
2- Fehling Réactif : Ce réactif est une solution bleue de sulfate de cuivre II (CuSO4) en milieu basique, car il est mélangé à une autre solution formée de soude (NaOH) et de tartrate de sodium et de potassium (NaOOC-CHOH-CHOH-COOK). Le tartrate est ajouté à la solution de sulfate de cuivre II pour la stabiliser et empêcher sa précipitation.
CUSO4 + 2 NaOH → Na2SEUL4 + Cu(OH)2
Fehling Reactive (du nom du chimiste allemand Hermann von Fehling (1812-1885))
Au contact du réactif de Fehling, un aldéhyde forme l'acide carboxylique par son oxydation, tandis que les ions cuivre (Cu)2+) présents au milieu sont réduits, formant un précipité brun rougeâtre (plus semblable à de la brique), qui est de l'oxyde cuivreux. Les cétones, en revanche, ne réagissent pas - car elles ne peuvent pas réduire les ions Cu2+.
O O
║ ║
R C ─ H + 2 Cu(OH)2 → R C OH + Cul2O + 2H2O
aldéhyde précipité brun rougeâtre
3- Le réactif de Benoît : Ce réactif est également formé par une solution de sulfate de cuivre II (Cu(OH)2) en milieu basique, mais il est mélangé avec du citrate de sodium.
Comme pour le réactif de Fehling, dans le cas de la réaction entre l'aldéhyde et le réactif de Benedict, il y a aussi des ions cuivre (Cu2+) présents dans le milieu qui sont réduits et forment de l'oxyde cuivreux rouge.
Ce réactif est largement utilisé dans les tests pour détecter la présence et la teneur en glucose dans les urines. Le glucose a un groupe aldéhyde dans sa structure, il réagit donc avec le réactif de Benedict présent dans les bandelettes pour ces tests. A partir de là, il suffit de comparer la couleur du ruban avec la couleur de l'échelle sur l'emballage du produit.

Le réactif de Benedict est utilisé pour déterminer la teneur en glucose dans l'urine.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/diferenciacao-aldeidos-cetonas.htm

