LES géométrie moléculaire, c'est-à-dire l'arrangement des atomes d'une molécule, peut être déterminé par la règle du chimiste Gillespie, dans lequel il liste le nombre d'atomes attachés à un atome central et le nombre de nuages électronique.
La connaissance de la géométrie d'une molécule est extrêmement importante car elle nous aide à déterminer la polarité et, par conséquent, la solubilité (selon la règle de similaire dissout similaire).
avec l'appel géométrie tétraédrique, n'est pas différent. Voir les critères pour le déterminer selon les règles de Gillespie :
Molécules pentatomiques (cinq atomes);
Absence de nuages électroniques dans l'atome central ;
molécules composites ou des anions composés.
Quelque exemples de molécules dont la géométrie est tétraédrique elles sont:
CH4

CH formule développée4
Le carbone a quatre électrons dans sa couche de valence et tous ces électrons se lient aux hydrogènes. C'est pourquoi le carbone n'a pas de nuage électronique (paire d'électrons supplémentaire).
SEUL4-2
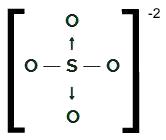
Formule structurelle du système d'exploitation4-2
Le soufre, qui a six électrons dans la couche de valence, fait deux liaisons simples avec deux atomes d'oxygène et deux liaisons covalentes datives avec les deux autres oxygènes. Dans les liaisons simples, il utilise deux de ses électrons et, dans chaque datif, il en utilise deux autres (total de quatre électrons impliqués dans les datifs), pour un total de six électrons. En tant que tel, il n'a plus de nuage.
NH4+

NH formule structurelle4+
L'azote, qui a cinq électrons dans la couche de valence, établit trois liaisons simples avec les atomes d'hydrogène et une liaison dative avec l'autre hydrogène. Dans les liaisons simples, il utilise trois de ses électrons et, en datif, il en utilise deux autres, pour un total de cinq électrons. En tant que tel, il n'a plus de nuage.
CH3Cl
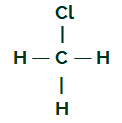
CH formule développée3Cl
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Le carbone a quatre électrons dans sa couche de valence et tous ces électrons se lient aux hydrogènes et à l'atome de chlore. Pour cette raison, le carbone n'a pas de nuage électronique.
→ Polarité de la molécule
Sachant qu'une molécule donnée a une géométrie tétraédrique, on peut déterminer sa polarité de forme extrêmement simple, puisque la molécule a ses quatre pôles occupés (quatre ligands dans l'atome central). Pour cela, il suffit de connaître les caractéristiques des liants et de considérer l'une des règles suivantes :
Si le nombre de nuages est égal au nombre de ligands égaux = molécule non polaire ;
Si le nombre de nuages est différent du nombre de ligands égaux = molécule polaire.
Dans les deux molécules suivantes, dont la géométrie est tétraédrique, on peut appliquer les règles ci-dessus et indiquer leur polarité :
Molécule de méthane
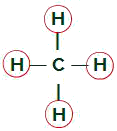
Ligands égaux dans la molécule de méthane
La molécule de méthane a quatre nuages d'électrons (quatre liaisons simples) et également quatre atomes d'hydrogène attachés à l'atome central. Ainsi, on aquatrenuages et quatre liants égaux, bientôt, le la molécule est non polaire.
Observation: Si la molécule de substance est apaiser, il se dissout bien dans une autre substance dont les molécules sont également non polaire.
Molécule de chlorométhane

Ligands égaux dans la molécule de chlorométhane
La molécule de chlorométhane a quatre nuages d'électrons (quatre liaisons simples) et trois atomes d'hydrogène et un atome de chlore attachés à l'atome central. Ainsi, on aquatrenuages et trois ligands égaux (trois hydrogènes); bientôt, le la molécule est polaire.
Observation: Si la molécule de substance est polaire, il se dissout bien dans une autre substance dont les molécules sont également polaire.
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. "Géométrie tétraédrique"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/geometria-tetraedrica.htm. Consulté le 28 juin 2021.



