Klo reaktiot kaksoisoksiditesiintyy, kun tämä oksidiluokka asetetaan astiaan, jossa on jokin seuraavista aineista:
- Vesi (H2O)
- Epäorgaaniset hapot (HX)
- Epäorgaaniset emäkset (WOH)
On huomionarvoista, että kaksoisoksidit ne ovat seurausta saman alkuaineen kahden eri oksidin välisestä assosiaatiosta, joilla on aina kaksi kationia.
Määritetään tuotteet, jotka muodostuvat kaksoisoksidireaktiot, on tarpeen tuntea näiden oksidien alkuaineiden kationit ja näistä kationeista muodostuneet anionit, kuten alla on esitetty:
Elementti rauta-
Kaksoisoksidissa alkuaine rauta on rauta II -kationin (Fe+2) ja rauta III (Fe+3). Lisäksi se on alkuaine, joka kykenee tuottamaan kaksi erilaista anionia: ferraatti (FeO4-2) ja ferriitti (FeO2-1).
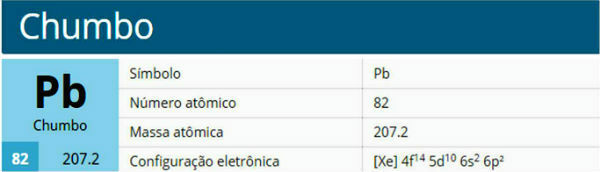
lyijyelementti
Kaksinkertaisissa oksideissa lyijyelementti on lyijyn II kationin muodossa (Pb+2) ja lyijy IV (Pb+4). Lisäksi se on alkuaine, joka kykenee tuottamaan kaksi erilaista anionia: putkilevy (PbO3-2) ja lyijy (PbO2-2).
Elementti tina
Kaksinkertaisissa oksideissa tinaelementti on tina II -kationin muodossa (Sn
+2) ja tina IV (Sn+4). Lisäksi se on alkuaine, joka kykenee tuottamaan kaksi erilaista anionia: stannataatti (SnO3-2) ja tina (SnO2-2).Elementti mangaani
Kaksinkertaisissa oksideissa alkuaine mangaani on mangaani II -kationin muodossa (Sn+2) ja mangaani III (Mn+3). Lisäksi se on alkuaine, joka kykenee tuottamaan kaksi erilaista anionia: manganaatti (MnO4-2) ja mangaania (MnO3-2).
Reaktiot kaksoisoksidien ja veden kanssa
Kun yksi kaksinkertainen oksidi reagoi veden kanssa, muodostuu kaksi epäorgaanista emästä (YOH), joista jokaisella on yksi oksidin muodostavista erilaisista kationeista, kuten seuraavassa yleisessä yhtälössä:
Y3O4 + H2O → Y (OH) + Y (OH)B
Merkintä.: Yhtälön indeksit a ja b viittaavat kunkin kaksoisoksidia muodostavan kationin varaukseen.
Esimerkiksi, jos kaksinkertainen rautaoksidi (Fe3O4) asetetaan veden läsnäollessa, muodostuu rauta II -hydroksidia [Fe (OH)2] ja rauta III -hydroksidi [Fe (OH)3], koska tässä kaksoisoksidissa on rauta II -kationeja (Fe+2) ja rauta III (Fe+3).
Nämä tuotteet (emäkset) muodostuvat, koska kaksoisrautaoksidissa (Fe3O4) läsnä on rauta II ja rauta III kationeja, jotka ovat vuorovaikutuksessa hydroksyylien (OH-1) vettä ja muodostavat emäkset seuraavan tasapainotetun yhtälön mukaisesti:
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Usko3O4 + 4H2O → 1Fe (OH)2 + 2Fe (OH)3
Reaktiot kaksoisoksidien ja emästen kanssa
Kun yksi kaksinkertainen oksidi reagoi emäksen kanssa Epäorgaaninen (WOH), muodostuu kaksi erilaista epäorgaanista suolaa ja vettä. Suolat muodostuvat emäskationin ja oksidin metallin muodostamien kahden anionin vuorovaikutuksesta seuraavan yhtälön mukaisesti:
Y3O4 + WOH → WYOç + WYOd + H2O
Merkintä.: Tuotteiden indeksit c ja d viittaavat oksidin metallin muodostamien anionien erilaisiin happimääriin.
Esimerkiksi: jos kaksinkertainen lyijyoksidi (Pb3O4) reagoivat kalsiumhydroksidin [Ca (OH) kanssa2ja kalsium on +2-latauskationi, muodostuu kalsiumplumbaattia (CaPbO3), joka on seurausta Ca: n välisestä vuorovaikutuksesta+2 ja PbO3-2ja kalsiumplumbiitti (CaPbO2), joka on seurausta Ca: n välisestä vuorovaikutuksesta+2 ja PbO2-2.
Nämä tuotteet muodostuvat, koska lyijyelementti muodostaa lyijyanionit (PbO2-2) ja plumbato (PbO3-2), jotka ovat vuorovaikutuksessa kalsiumkationin (Ca+2) kalsiumoksidia. Seuraava on tämän prosessin tasapainoinen yhtälö:
1Pb3O4 + 3Ca (OH)2 → 1CaPbO3 + 2CaPbO2 + 3H2O
Reaktiot kaksoisoksidien ja happojen kanssa
Kun yksi kaksoisoksidi reagoi epäorgaanisen hapon kanssa (HX) tapahtuu muodostamalla kaksi erilaista epäorgaanista suolaa ja vettä. Suolat muodostuvat vuorovaikutuksesta kunkin kaksoisoksidia muodostavan kationin ja anionin (X-) happoa seuraavassa yhtälössä:
Y3O4 + HX → YX + YX + H2O
Jos kaksoismangaanioksidi (Mn3O4) reagoivat fosforihapon (H3PÖLY4), muodostuu mangaanifosfaatti II: ta [Mn3(PÖLY4)2], koska vuorovaikutus Mn+2 ja PO4-3ja mangaanifosfaatti III (MnPO4), joka johtuu Mn+3 ja PO4-3.
Nämä tuotteet muodostuvat, koska kaksoismangaanioksidissa on mangaanikationeja II ja mangaani III, jotka ovat vuorovaikutuksessa hapon fosfaattianionin kanssa, kuten tasapainotetussa yhtälössä a seuraa:
3Mn3O4 + 8h3PÖLY4 → 1Mn3(PÖLY4)2 + 6MnPO4 + 12:002O
Minun luona. Diogo Lopes Dias
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
PÄIVÄT, Diogo Lopes. "Reaktiot kaksoisoksidien kanssa"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/reacoes-com-oxidos-duplos.htm. Pääsy 28. kesäkuuta 2021.