THE clapeyronin yhtälö on matemaattinen lauseke, joka liittyy suureisiin, kuten paine (P), tilavuus (V), lämpötila (T) ja a muodostavien hiukkasten lukumäärä (n) täydellinen tai ihanteellinen kaasu. Tämä yhtälö on nimetty ranskalaisen fyysikon mukaan Paulemileclapeyron ja se voidaan ymmärtää yleistyksenä empiirisistä laeista kaasujatäydellinensisäänGay-Lussac, Charles ja Boyle. Se oli välttämätöntä ihanteellisten kaasujen tutkimuksessa ja mahdollisti Lämpökoneet, mikä tekee niistä yhä tehokkaampia viime vuosikymmeninä.
Katso myös: Fyysiset löydöt, joita tapahtui vahingossa
Clapeyronin yhtälö: ihanteellinen kaasulaki
Clapeyronin yhtälö on johdettu kolmesta empiirisestä laistaeli kokeiden perusteella määritetyt lait. Tällaiset lait selittävät kaasujen käyttäytymistä kaasumuunnoksetisovolumetrinen (Gay-Lussac-laki), isobaarinen (Kaarlen laki) ja isotermit (Boylen laki). Näiden lakien mukaan:
muutoksissa isovolumetrinen, ihanteellisen kaasun paineen ja termodynaamisen lämpötilan suhde pysyy vakiona;
muutoksissa isobaarinen, ihanteellisen kaasun tilavuuden ja termodynaamisen lämpötilan suhde on vakio;
- muutoksissa isotermit, ihanteellisen kaasun paineen ja tilavuuden tulo pysyy vakiona.
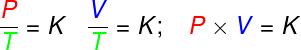
P - paine (Pa - pascal)
V - kaasun tilavuus (m³)
T - termodynaaminen kaasun lämpötila (K - kelvin)
Edellä olevasta kolmesta laista Clapeyronin yhtälö määrittää tämän arvon vakio (K) saatu jokaisessa edellä mainitussa muunnoksessa. Clapeyronin yhtälön mukaan tämä vakio on yhtä suuri kuin moolien määrä kerrottuna a: lla vakio R, joka tunnetaan ihanteellisten kaasujen universaalivakiona ja on yhtä suuri kuin Boltzmannin vakio kerrottuna Avogadron numero.
Kaava
Tarkista kaava, joka tunnetaan nimellä yhtälösisäänClapeyron:
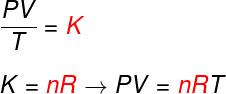
ei - moolien lukumäärä (mol)
R - ihanteellisten kaasujen yleisvakio (R = 0,082 atm.l / mol. K tai 8,314 J.mol / K)
Analysoimalla Clapeyron-yhtälöä voidaan nähdä, että paine ihanteellisten kaasujen aiheuttama on suoraan verrannollinen lämpötilaan ja myös moolien lukumäärä. Lisäksi, paine on kääntäen verrannollinen tilavuuteen kaasun käytössä.
O ihanteellinen kaasumalli Clapeyronin yhtälön avulla mahdollista käytetään laajalti - moottorikäyttöisten koneiden kehittäminen nesteitä, kuten höyrykäyttöiset koneet ja polttomoottorit.
Clapeyronin yhtälöstä voitaisiin saada useita tärkeitä tuloksia. Yksi niistä esimerkiksi ennustaa, että 1 mooli mitä tahansa ihanteellista kaasua vie tilavuuden 22,4 litraa kun se altistetaan 1 atm (1,01.105 Pa) ja lämpötilassa 273 kt (0 ° C).
Katso myös: Tärkeimmät termologian käsitteet
Clapeyron-yhtälön ratkaistut harjoitukset
Kysymys 1 - (UECE) Kaasulla, jonka lämpötila, tilavuus ja paine voidaan laskea PV = nRT mukaan, on seuraavat ominaisuudet:
a) molekyylien välinen erittäin suuri keskimääräinen etäisyys molekyylien välisten vuorovaikutusten huomioon ottamiseksi, paitsi törmäyksessä; molekyylit käyvät läpi elastisia törmäyksiä.
b) hyvin pieni keskimääräinen etäisyys molekyylien välillä; molekyylit törmäävät joustamattomiin törmäyksiin.
c) molekyylien välinen erittäin suuri keskimääräinen etäisyys molekyylien välisten vuorovaikutusten huomioon ottamiseksi, paitsi törmättäessä; molekyylit törmäävät joustamattomiin törmäyksiin.
d) molekyylien välinen erittäin suuri keskimääräinen etäisyys ja vahvat molekyylien väliset vuorovaikutukset; molekyylit käyvät läpi elastisia törmäyksiä.
Resoluutio:
Ihanteellisessa kaasumallissa suuri määrä ulottumattomia hiukkasia liikkuu suurella nopeudella satunnaisiin suuntiin. Ainoa vuorovaikutus, jota nämä hiukkaset kärsivät, ovat täysin joustavia törmäyksiä, joten oikea vaihtoehto on kirjain a.
Kysymys 2 - (UFRGS) Harkitse seuraavia väitteitä ihanteellisista kaasuista.
I. Kaasujen tilayhtälössä olevalla vakiolla R p = nRT on sama arvo kaikille ihanteellisille kaasuille.
II. Yhtä tilavuudet erilaisia ihanteellisia kaasuja samassa lämpötilassa ja paineessa sisältävät saman määrän molekyylejä.
III. Ihanteellisen kaasun molekyylien keskimääräinen kineettinen energia on suoraan verrannollinen kaasun absoluuttiseen lämpötilaan.
Mitkä ovat oikeita?
a) Vain minä
b) Vain II
c) Vain III
d) Vain I ja II
e) I, II ja III
Sapluuna:
Katsotaanpa vaihtoehtoja:
I. oikea, siksi sitä kutsutaan ihanteellisten kaasujen universaaliksi vakiona.
II. oikea. Clapeyronin yhtälön mukaan, jos kahdella ihanteellisella kaasulla on sama paine, lämpötila ja tilavuus, niin hiukkasten lukumäärä näissä kaasuissa on sama.
III. oikea. Energiaerotuslauseen mukaan ihanteellisessa kaasussa olevien hiukkasten kineettinen energia on verrannollinen sen lämpötilaan.
Siksi oikea vaihtoehto on e-kirjain.
Kysymys 3 - (UFJF) Miehet, kuten Clapeyron, Boyle, Mariotte, Gay-Lussac, van der Walls, ovat kehittäneet tärkeitä tutkimuksia kaasujen ominaisuuksista. Todellisten kaasujen käyttäytyminen on lähellä ihanteellisia kaasuja matalapaineisissa olosuhteissa, samoin kuin suuressa tilavuudessa olevia kaasuja ja korkeissa lämpötiloissa pidettyjä kaasuja. Otetaan huomioon, että laboratoriotutkimuksessa astia V on täysin suljettu ja sisältää 1 mol ihanteellista kaasua 4,0 paineen alaisena atm joutuu paisumaan vakiolämpötilassa, joka on 127 ºC, ja että tämän kaasun käyttäytyminen on ihanteellisen kaasun käyttäytymistä, kuten graafinen.
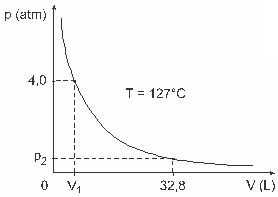
Tässä tapauksessa, kun kaasu käyttää 32,8 litran tilavuutta, sen aiheuttama paine on:
(Annetaan: täydellisten kaasujen universaalivakio on R = 0,082 atm. L / mol. K.)
a) 0,32 atm
b) 0,40 atm
c) 1,0 atm
d) 2,0 atm
e) 2,6 atm
Resoluutio:
Kirjain C.
Harjoituksen ratkaisemiseksi meidän on sovellettava tietoja Clapeyronin yhtälöön, mutta ennen sitä meidän on muutettava Celsius-asteina oleva lämpötila kelviiniksi. Tarkista:

Kirjailija: Rafael Hellerbock
Fysiikan opettaja
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/fisica/a-equacao-clapeyron.htm

