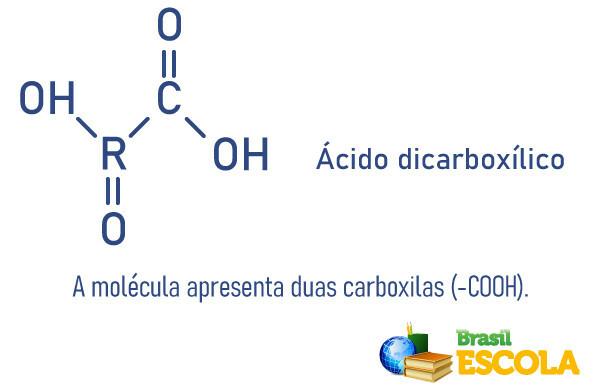
Jaksollisen taulukon perheen 17 tai VII A elementtejä kutsutaan halogeeneiksi, joita edustavat seuraavat viisi elementtiä: Fluori (F), kloori (Cl), bromi (Br), jodi (I) ja Astatine (At). Niitä edustaa yleisesti X-kirjain.

Tärkeimmät päivittäisen käytön vuoksi ovat kloori, bromi ja jodi.
Tämä nimi "halogeeni" tarkoittaa "suolan muodostumista".
Kaikilla heillä on 7 elektronia valenssikuoressa (elektroninen kuori ytimestä ulospäin ja energisempi). Yleensä: ns2 np5. Tämän seurauksena heillä on taipumus vastaanottaa elektroni ja muodostaa negatiivisia yksiarvoisia ioneja (X-1), reagoimalla pääasiassa alkalimetallien (perheen 1 metallit) kanssa, jotka yleensä luovuttavat elektronia. Siten ne tuottavat yhdisteitä, joiden kaavat ovat MX-tyyppisiä.

Saamalla tämä elektroni, halogeenit ovat stabiileja, koska niiden valenssikuori on täydellinen (kahdeksan elektronin kanssa) ja niiden ominaisuudet muuttuvat kokonaan. Esimerkiksi kloorikaasu (Cl2) on vihertävän keltainen, tiheä, erittäin myrkyllinen ja reaktiivinen kaasu, veteen liukenevasti ja reagoi räjähdysmäisesti vedyn kanssa. Kuitenkin, kun
kloori (Cl) saa elektronin natriumista (Na), niistä tulee ioneja, jotka muodostavat natriumkloridia (NaCl) tai pöytäsuolaa, jota nautimme päivittäin ja joka on välttämätöntä elämämme ylläpitämiseksi. Kloorista tulee erityisesti kloridi-ioni (Cl-), joka on välttämätöntä kehossamme suolahapon (HCl), mahalaukun mehun pääkomponentin, muodostamiseksi.Klooria on itse asiassa eniten halogeeneista, ja sitä käytetään orgaanisten yhdisteiden tuotannossa, epäorgaaniset aineet, paperinvalmistuksessa (massan valkaisuun tähtäävä) ja vedessä ja viemärit. On myös yleistä käyttää natriumhypokloriitin (NaClO) vesiliuosta, jota kutsutaan nestemäiseksi klooriksi ja joka on valkaisuainekoostumuksessa.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Mielenkiintoinen tosiasia on, että vaikka jotkut sanovat, että "kiinteää klooria" käytetään uima-altaissa, se ei oikeastaan ole vain alkuaine klooria, vaan kalsiumhypokloriittia (Ca (ClO)2).
Samankaltainen tapaus on myös fluori - joka ei itse asiassa ole fluoria sinänsä, vaan fluorideja (ioniyhdisteitä, jotka sisältävät alkuainefluoria) - juomaveden käsittelyssä ja suunhoitotuotteissa.
Suhteessa jodi, tärkeä sovellus on niiden lisääminen (jodidien tai natrium- ja kaliumjodaattien muodossa), jota laki vaatii, pöytäsuolaan. Tämä johtuu siitä, että jodin puute elimistössä voi aiheuttaa taudin, jota kutsutaan struuma, joka tunnetaan yleisesti nimellä papo.

O bromi se on punainen neste, huoneenlämpötilassa, tiheä ja epävakaa, ja haihtuvana se voi haihtua muodostaen punertavan höyryn. Sitä ei löydy luonnosta erillään, eikä sitä käytetä teollisuudessa tällä tavalla. Sen yhdisteiden pääasialliset sovellukset ovat: orgaanisten reaktioiden katalysaattoreina sekoitettuna polttoaineisiin muun muassa valokuvauskehityksessä.
jo astatiini se on radioaktiivinen elementti. Sen alkuperä johtuu yleensä uraani- ja torium-isotooppien radioaktiivisesta hajoamisesta. Se muodostaa vähintään 20 isotooppia, joista At-210 on vakain ja jonka puoliintumisaika on 8,3 tuntia. Se on hyvin harvinainen elementti.
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta