Vuonna 1926 tiedemies Werner Heisenberg (1901-1976) totesi sen tietyn atomin elektronin nopeutta ja sijaintia ei ole mahdollista määrittää samanaikaisesti suurella tarkkuudella. Itse asiassa on mahdollista määrittää elektronin sijainti tai nopeus erikseen, mutta kun yhden määrittämisen tarkkuus kasvaa, toisen määrittämisen tarkkuus menetetään. Se tarkoittaa, että mitä tarkemmin elektronin sijainti mitataan atomissa, sitä epätarkemmin sen liikkumisnopeus määritetään ja päinvastoin.
Suuren esineen, kuten auton sijainti ja nopeus on helppo määrittää. elektroni on kuitenkin mikroskooppinen, joten sen nopeuden ja sijainnin määrittäminen ei ole mahdollista, koska mittauslaitteet itse muuttavat näitä määrityksiä.
Siten hyväksyttiin, että sen sijaan, että määritettäisiin vain elektronille määritelty kiertorata, on tarkoituksenmukaisempaa ja oikeampi myöntää, että alueilla tämän elektronin on mahdollista olla. Nämä alueet, joilla todennäköisyys löytää elektroni atomista on suurin, Oli kutsuttu kiertoradat.
Tutkija Erwin Schrödinger teki laskelmat tämän alueen määrittämiseksi ja keksi yhtälön seuraavat elektronin määrät: massa, energia, varaus ja korpuskulaarinen luonne, eli sen luonne hiukkanen*.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Tämän yhtälön tulosten avulla oli mahdollista tunnistaa elektronit niiden perusteella energiasisältö, sen neljän kautta kvanttiluvut (yhtälön numeeriset ratkaisut). Nämä kvanttiluvut ovat: pää-, toissijainen tai atsimutaalinen, magneettinen ja spin.
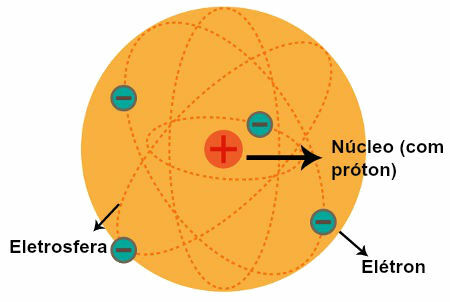
Näiden numeroiden kautta tiedämme nyt, että elektronit ovat järjestyneet atomiytimen ympärille (kuten alla olevassa kuvassa on esitetty) ja että jokaisella elektronilla on omat kvanttinumeronsa; ei ole mahdollista, että kahdella samassa atomissa olevalla elektronilla on samat kvanttiluvut.

* Ranskalaisen fyysikon Louis De Broglien mukaan elektronilla on kaksi ominaisuutta, toisin sanoen sillä on hiukkasaaltokäyttäytyminen. Jokainen elektroni liittyy myös aaltoon. Siksi suoritetusta tutkimuksesta riippuen elektroni katsotaan joko hiukkaseksi tai aalloksi. Tässä tapauksessa sen luonne hiukkasena oli yhteydessä toisiinsa.
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Heisenbergin epävarmuuden periaate"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/o-principio-incerteza-heisenberg.htm. Pääsy 28. kesäkuuta 2021.