Lukio-opiskelijat joutuvat aina kohtaamaan redox-reaktiot kanssa ioneja, sekä valintakokeissa että kansallisessa lukiokokeessa (Enem). Siten näiden yhtälöiden tasapainottaminen voi olla paljon pelätty aihe.
Tämän tekstin ymmärtämisen helpottamiseksi tässä tekstissä pyritään käsittelemään Redox-yhtälöiden tasapainottaminen ionien kanssa kuvaus joidenkin vaiheiden suorittamisesta. Tätä varten meidän on aloitettava tunnistamalla tämän tyyppinen kemiallinen reaktio.
Klo redoksireaktiot ionien kanssa tunnistetaan yhden tai useamman komponentin läsnä ollessa (positiiviset tai negatiiviset) varaukset, ts ionit (kationit tai anionit), joita voi olla reagensseissa tai tuotteissa, kuten kahdessa esimerkissä a seuraa:
1. esimerkki:Kr2O72- + Fe2+ + H+ → Kr3+ + Fe3+ + H2O
2. esimerkki:Cl2 + C + H2O → CO2 + H+ + Cl-
Suorita tasapainottavat redoksireaktioiden yhtälöt ionien kanssa, on välttämätöntä noudattaa joitain vaiheita, kuten:
1. vaihe: määrittää NOX reaktanttien jokaisesta atomista ja yhtälön tuotteista;
2. vaihe: tarkista kärsivät lajit hapettuminen;
3. vaihe: määritä variaatio NOX hapettunut laji;
4. vaihe: kerro kolmannessa vaiheessa havaittu vaihtelu hapettavien lajien atomien määrällä;
5. vaihe: tarkista, mitkä lajit kärsivät vähentäminen;
6. vaihe: määritetään pelkistyneiden lajien NOX-vaihtelu;
7. vaihe: kerro kolmannessa vaiheessa havaittu vaihtelu sen vähentämien lajien atomien määrällä;
8. vaihe: käytä neljännen vaiheen arvoa pienentävän lajin kertoimena;
9. vaihe: käytä seitsemännen vaiheen arvoa hapettavien lajien kertoimena;
10. vaihe: laita kertoimet muihin lajeihin menetelmän mukaisesti koetasapainotus. Niissä lajeissa, joissa tämä ei ole mahdollista, lisää tuntemattomat kertoimiksi;
11. vaihe: kerro kunkin lajin kerroin sen kuormalla;
12. vaihe: Tasaa reagoivien aineiden ja tuotteiden varausten summa, jotta löydetään yhden tuntemattomien lajien kerroin;
13. vaihe: viimeistele tasapaino kokeilumenetelmällä.
Ymmärtämisen helpottamiseksi noudata yllä kuvattuja vaiheittaisia ohjeita seuraavassa esimerkissä a redox-yhtälö ionien kanssa:

Ioninen yhtälö, joka näyttää joitain ioneja ja yleisiä varausryhmiä 0
1. vaihe: Kunkin atomin NOX.

Yhtälössä olevien atomien NOX
2. vaihe: Hapettuvat lajit.

Lajit, jotka yhtälössä hapettuvat
Kun jodin NOX nousee arvosta -1 arvoon 0 reagoivasta tuotteeksi, hapetetaan siis laji.
3. vaihe: Määritä hapettuneiden lajien NOX-vaihtelu.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Voit tehdä tämän vain vähentämällä korkeimman NOX: n pienimmällä NOX: lla:
∆NOX = (0) – (-1)
∆ NOX = 0 + 1
∆ NOX = 1
Vaihe 4: NOx: n kertominen määrällä.
Tässä vaiheessa kerrotaan kolmannessa vaiheessa löydetty vaihtelu lajin atomien määrällä.
Minä- = ∆NOX.1
Minä- = 1.1
Minä- = 1
5. vaihe: Lajit, joille tehdään pelkistys.

Lajit, jotka kärsivät yhtälön pienenemisestä
Kun kromi-NOX vähenee +7: stä +3: een reagoivasta tuotteesta, pelkistyminen tapahtuu siksi lajeissa.
6. vaihe: Määritä pelkistetyn lajin NOX-vaihtelu.
Voit tehdä tämän vain vähentämällä korkeimman NOX: n pienimmällä NOX: lla:
∆NOX = (+6) – (+3)
∆ NOX = +6 – 3
∆ NOX = 3
7. vaihe: NOx: n kertominen määrällä.
Tässä vaiheessa kerrotaan kuudennessa vaiheessa löydetty vaihtelu lajin atomien määrällä.
Kr2O72- = ∆NOX.1
Kr2O72- = 3.2
Kr2O72- = 6
8. vaihe: Aloita tasapainottaminen.
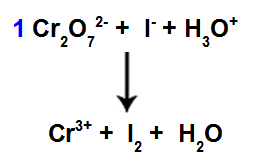
Tasapainotuksen alku käyttämällä löydettyä kerrointa
Tässä vaiheessa aloitamme tasapainottamisen sijoittamalla vähennyksen kärsineisiin lajeihin neljännestä vaiheesta löytyvän kertoimen.
9. vaihe: Jatka tasapainottamista.

Tasapainotuksen jatkaminen käyttämällä löydettyä kerrointa
10. vaihe: Käytä kokeilumenetelmää.
Reagenssissa on 6 I-atomia, joten kerroin 3 on asetettava I-lajeihin2 tuotteen, koska siinä on vain 2 Cl-atomia;
Kuten lajeissa 1, kr2O72-, on 2 Cr-atomia, meidän pitäisi laittaa kerroin 2 Cr-lajeihin3+ tuotteen.
Koska happea on kolmessa lajissa, ja kahdessa niistä ei ole kertoimia, tasapainon jatkamiseksi meidän on sijoitettava tuntemattomia muihin lajeihin:
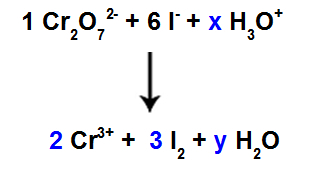
Kertoimet koemenetelmän käytön jälkeen
11. vaihe: Kunkin lajin kertominen sen kuormituksella.
Voit tehdä tämän vain kertomalla lajin kerroin sen kuormalla seuraavasti:
Reagensseissa:
Kr2O72- = 1.(-2) = -2
Minä- = 6.(-1) = -6
H3O+ = x. (+ 1) = + x
Tuotteista:
Kr3+ = 2.(+3) = +6
Minä2 = 4.0 = 0
H2O = y.0 = 0
12. vaihe: Maksujen summa.
Tässä vaiheessa meidän on lisättävä vaiheessa 11 löydetyt reagenssit ja tuotteet:
Reagenssit = tuotteet
-2 + (-8) + (+ x) = +6 + 0 + 0
-2 - 6 + x = 6
-8 + x = 6
x = 6 + 8
x = 14
13. vaihe: Tasapainotuksen loppu.
Tasapainotuksen viimeistelemiseksi meidän on:
Laita tulos 12. vaiheesta lajeihin H3O+;
Koska reagenssissa on nyt 42 H-atomia, on tarpeen sijoittaa kerroin 21 H-lajeihin2Tuotteessa oleva.
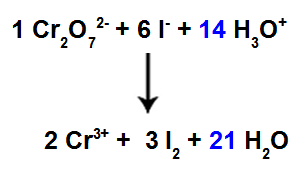
Tasapainoinen ionisen reaktion yhtälö
Minun luona. Diogo Lopes Dias
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
PÄIVÄT, Diogo Lopes. "Puna-pelkistysreaktiot ionien kanssa"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-com-ions.htm. Pääsy 28. kesäkuuta 2021.


