Amerikkalainen kemisti Gilbert N. Lewis (1875-1946) ehdotti oktettisääntöä, joka sanoo:
"Eri alkuaineiden atomit muodostavat kemiallisia sidoksia luovuttamalla, vastaanottamalla tai jakamalla elektroneja saadakseen elektronisen konfiguraation jalokaasu, ts. 8 elektronia viimeisessä kuoressa (tai 2 elektronia niiden atomien tapauksessa, joissa on vain yksi elektronikuori, kuten tapahtuu vety)."
Vuonna 1916 Lewis ehdotti pysyvän vakaana saavuttaen oktetin tai duetin, elementit, jotka muodostavat molekyyliaineet suorittaa elektroniparien jakaminen. Nämä aineet muodostuvat vain vety, ei-metallit ja puolimetallit, kaikki taipumus vastaanottaa elektroneja. Siksi kukaan heistä ei voi mitenkään lahjoittaa elektronia (kuten metallien ollessa ionisidoksissa), mutta jokaisen on vastaanotettava, joten he jakavat elektroninsa kovalenttisen sidoksen kautta tai molekyylinen.
Siten Gilbert Lewis ehdotti tapaa edustaa kovalenttista tai molekyylisidosta, joka tunnettiin nimellä Lewisin kaava. Häntä kutsutaan myös
sähköinen kaava tai vielä, Lewisin elektroninen kaava, koska sen pääominaisuus on se näyttää kunkin atomin valenssikuoressa olevat elektronit ja elektronisten parien muodostumisen.Kutakin elektronia edustaa piste., joka ympäröi vastaavan kemiallisen elementin symbolia. Vain valenssikuoren elektronit ovat elementin ympärillä.
Kuten alla olevasta taulukosta ilmenee, tietää vain valenssikuoressa olevien elektronien määrä, vain jaksollisen järjestelmän perhe:
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)

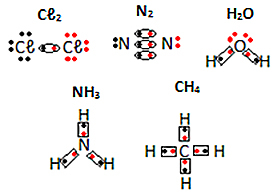
Lewis-kaavassa kukin jaettu elektronipari edustaa kemiallista (kovalenttista) sidosta, missä elektronit kohtaavat sähköpallon alueella, joka on yhteinen kullekin toisiinsa liittyneelle atomiparille. Siksi esityksessä ne sijoitetaan vierekkäin.
Selvitetään esimerkiksi, mikä on Lewisin kaava vetykaasulle, jonka molekyylikaava on: H2.
Jokaisella vetyatomilla on vain yksi elektroni valenssikuoressa, koska tämä elementti kuuluu jaksollisen järjestelmän perheeseen 1. Jokaisen on vastaanotettava vielä yksi elektroni, jotta se olisi vakaa, ja kaksi elektronia olisi K-elektronikuoressa. Joten he jakavat elektroninsa ja molemmat saavat kaksi. Katso:
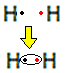
Tämä on Lewisin kaava vetykaasumolekyylille.
Hapen elektronikuoressa on kuusi elektronia, joten jokaisen on vastaanotettava vielä kaksi elektronia ollakseen vakaa ja kahdeksan elektronia. Siksi happikaasumolekyylin Lewis-kaava on:

Katso, että linkkejä on kaksi, koska on olemassa kaksi jaettua paria.
Katso muut esimerkit molekyyliaineiden elektronisista kaavoista alla:
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Lewis Electronic Formula"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/formula-eletronica-lewis.htm. Pääsy 28. kesäkuuta 2021.
Hiilen avaruuskaava, Lewisin elektroninen kaava, tasorakenne, elektroniset parit, sidos kovalenttinen, valenssikerros, atomimallin evoluutio, molekyylikaava, rakennekaava, kaavat kolmiulotteinen.
Kemialliset kaavat, tasainen rakennekaava, kytkimen rakennekaava, kolmoissidos, kaasu typpi, elektroninen kaava, Lewis-kaava, molekyylikaava, yksinkertainen sidos, kaksoissidos, kaasu hiilihappo.
Kemia
Molekyyliaineet, kiehumislämpötila, kosketuspinta, kiehumispiste, molekyylien väliset vetovoimat, kemialliset sidokset, molekyyliyhdisteet, kovalenttiset kemialliset sidokset, ionisidokset, metallisidokset, huono