THE Sähkökemia on fyysisen kemian haara, joka tutkii reaktioita, joissa tapahtuu elektroninsiirtoa (oksi-pelkistysreaktioita), ja sen reaktioita muuntaminen sähköenergiaksi sekä päinvastainen prosessi, toisin sanoen sähköenergian muuntaminen energiaksi kemia.
Ensimmäinen prosessi on mitä tapahtuu Paristot. Paristot ovat laitteita, jotka on muodostettu kahdesta elektrodista (positiivinen napa, joka on katodi, ja negatiivisesta napasta, joka on anodi) elektrolyytin (johtavan liuoksen) lisäksi. Elektronit siirtyvät ulkoisella johtimella anodista katodiin, muodostaen sähkövirran, jota käytetään jonkin laitteen kytkemiseen päälle. Paristot koostuvat useista kennoista, jotka on kytketty sarjaan tai rinnakkain.
Tämä on spontaani prosessi ja energiaa syötetään, kunnes kemiallinen reaktio on loppunut (kuten primaarikennojen ja paristojen, kuten Leclanchén kuivakennon ja pariston tapauksessa) alkalinen), tai palautuvien reaktioiden tapauksessa voidaan soveltaa potentiaalieroa ja reaktio päinvastaiseksi muodostaen reaktantit uudelleen ja lataamalla akun, joka on käyttövalmis uudelleen (näin on autoissa käytetyissä paristoissa ja toissijaisissa paristoissa, kuten lyijyssä ja laitteissa Kännykät).

Ensisijaiset kennot ja paristot etualalla ja toisessa lataavat toissijaiset paristot (lyijy ja litiumioni)
Käänteinen prosessi ei ole spontaani ja sitä kutsutaan elektrolyysi. Elektrolyysi on sähkövirran kulkua generaattorista, kuten kennosta tai akusta, ionisen nesteen läpi. Jos neste on sulaa ainetta, meillä on magma-elektrolyysi, mutta jos se on vesiliuos, meillä on vesipitoinen elektrolyysi.
Kun sähkövirta kulkee nestemäisen väliaineen yli, generaattori "vetää" elektronit positiivisesta napasta (anodi - se on päinvastainen kuin akku) ja siirtää ne negatiiviseen napaan (katodi), ts. katodi pelkistyy ja anodi käy läpi hapettuminen. Siten generaattorin syöttämä sähköenergia muuttuu redoksireaktioksi (kemiallinen energia). Alla on vesielektrolyysikaavio:
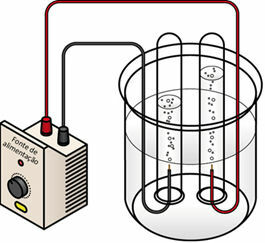
Veden elektrolyysikaavio
Elektrolyysiä käytetään laajasti teollisesti tärkeiden aineiden, kuten alumiinin, kloorikaasun, metallisen natriumin, valmistuksessa ja erilaisten metallien puhdistamiseksi tai suojaamiseksi, kuten galvanointi- tai galvanointiprosesseissa, jotka koostuvat jonkin esineen päällystämisestä metallilla, kuten hopeaminen, kuparipinnoitus, nikkelipinnoitus, kultaus ja kromaatio; kun teräs on päällystetty sinkillä, sitä kutsutaan sinkitykseksi.
Kohdassa Sähkökemia verkkosivuiltamme löydät lisätietoja kaikista kennoihin ja paristoihin liittyvistä näkökohdista sekä elektrolyysistä.
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletroquimica.htm
