THE liukoisuus tai liukoisuuskerroin, se on aineen fyysinen ominaisuus, joka määritetään aina käytännössä laboratoriossa. Se liittyy materiaalin kapasiteettiin liuenneen aineen, esittelee, että toinen, liuotin.
Liukoisuuden suhteen liuenneet aineet voidaan luokitella seuraavasti:
Liukoiset: ne, jotka liukenevat liuottimeen. Esimerkiksi natriumkloridi (liuotettu aine) liukenee veteen (liuotin);
Hieman liukeneva: ne, joilla on vaikeuksia liuottaa liuottimeen. Näin on kalsiumhydroksidilla [Ca (OH)2] (liuotettu aine) vedessä;
Liukenemattomat: ne eivät liukene liuottimeen. Esimerkiksi hiekka (liuotettu aine) ei liukene veteen.
THE liukoisuus liittyy hyvin valmisteen ratkaisuja (homogeeniset seokset), koska liuoksen saamiseksi on välttämätöntä, että käytetty liuoteaine liukenee liuottimeen.
Liukoisuuteen vaikuttavat tekijät
Vaikka liuenneen aine liukenisi liuottimeen, on joitain tekijöitä, jotka voivat vaikuttaa liuenneen aineen liukenemiskykyyn. Ovatko he:
a) Liuotetun aineen ja liuottimen määrän suhde
Liuottimella on aina raja-arvo liuenneita aineita, joita se voi liueta. Jos lisäämme liuottimen määrää säilyttäen liuenneen aineen määrän, liuotin pyrkii liuottamaan kaiken käytetyn liuenneen aineen.
B) Lämpötila
Lämpötila on ainoa fysikaalinen tekijä, joka pystyy muuttamaan liuottimen liukoisuutta tiettyyn liuenneeseen aineeseen nähden. Tämä muutos riippuu liuenneen aineen luonteesta, kuten näemme alla:
endoterminen liuotin: on sellainen, että onnistumme liuottamaan suuremman massan, kunhan liuotin on huoneenlämpötilaa korkeammassa lämpötilassa. Mitä kuumempi liuotin, sitä enemmän liukenevaa ainetta liukenee.
Esimerkki: On mahdollista liuottaa suurempi määrä jauhettua kahvia, kun vesi on kuumaa.
Eksoterminen liuotin: on se, jonka onnistumme liuottamaan suuremman massan, kunhan liuotin on huoneenlämpötilaa alhaisemmassa lämpötilassa. Mitä kylmempi liuotin, sitä enemmän liukenevaa ainetta liukenee.
Esimerkki: On mahdollista liuottaa suurempi määrä hiilidioksidia, kun sooda on kylmä.
Tapoja määrittää liukoisuus
Koska liukoisuus on kokeellisella tavalla määritetty ominaisuus, materiaalien liukoisuus on yleensä jo arvioitu useimmissa eri liuottimissa. Siten pääsemme liuenneen aineen liukoisuuteen tietyssä liuottimessa seuraavasti:
a) Taulukon analyysi
Usein opiskelija voi kohdata liukoisuuden taulukon tulkinnasta. Katso seuraava esimerkki:
Esimerkki: (UEPG - mukautettu) Alla olevassa taulukossa esitetään Li-suolan liukoisuus2CO3 100 grammassa vettä.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)

Taulukossa esitetään massa-arvot litroina grammoina2CO3 joka voidaan liuottaa 100 grammaan vettä, 0: sta OC - 50 OÇ. Voimme nähdä, että mitä kuumempi vesi, sitä vähemmän Li2CO3 liukenee. Siksi Li2CO3 se on eksoterminen liuoteaine (se liukenee enemmän, jos vesi on kylmä).
b) Kuvaajan analyysi
Liukoisuus voidaan arvioida tulkitsemalla kaavio. Voit tehdä tämän yksinkertaisesti määrittämällä lämpötila, kääntämällä se käyrään ja kääntämällä sitten käyrä y-akselille, joka on liuenneen aineen massa grammoina.
Esimerkki: (UFTM - mukautettu) Kaavio näyttää AX-suolan liukoisuuskäyrän2.
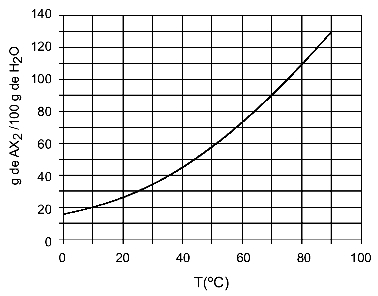
Kaavion mukaan y-akselilla veden määrä (liuotin) on 100 grammaa. Liuotetulle AX: lle2, määritämme veden määrän seuraavissa lämpötiloissa:
30OÇ: Kun käynnistämme lämpötilan 30OC käyrälle ja sitten käyrä y-akselille, meillä on, että tässä lämpötilassa 100 grammaa vettä voi liuottaa noin 35 grammaa liuotettua AX: ää2.
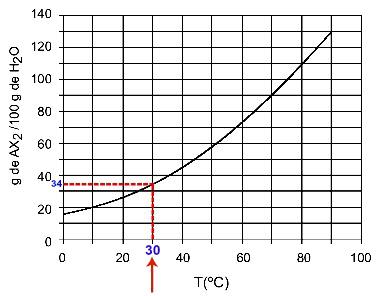
AX-liukoisuuden määrittäminen2 klo 30OÇ
40OÇ: Kun käynnistämme lämpötilan 40OC käyrälle ja sitten käyrä y-akselille, meillä on, että tässä lämpötilassa 100 grammaa vettä voi liuottaa noin 45 grammaa liuotettua AX: ää2.
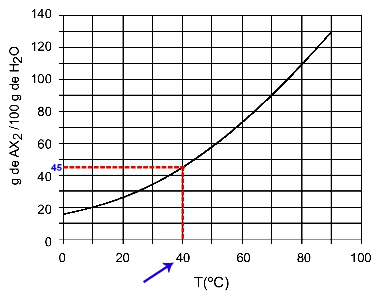
AX-liukoisuuden määrittäminen2 40: ssäOÇ
Koska liuenneen aineen liuennut määrä on suurempi lämpötilan nousun myötä, meillä on AX2 se on endoterminen liukeneva aine.
c) tekstitulkinta
Katso seuraava esimerkki:
Esimerkki: (PUC-MG) Tietyt aineet voivat muodostaa homogeenisia seoksia muiden aineiden kanssa. Suurinta määrää ainetta kutsutaan liuottimeksi ja ainetta, jota on pienin määrä, liuenneeksi aineeksi. Natriumkloridi (NaCl) muodostaa homogeenisen liuoksen veden kanssa, jossa on mahdollista liuottaa 20 g: n lämpötilassa 36 g NaCl: a 100 g: aan vettä.
Tekstissä todetaan, että jos meillä on 100 grammaa vettä (liuotinta), 20 ° C: n lämpötilassa OC, on mahdollista liuottaa jopa 36 grammaa NaCl: a.
Minun luona. Diogo Lopes Dias
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
PÄIVÄT, Diogo Lopes. "Mikä on liukoisuus?"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-solubilidade.htm. Pääsy 28. kesäkuuta 2021.

