Hapot ovat aineita, jotka ionisoida vesipitoisessa väliaineessa ja ovat hyviä johtimet teho. Aineen happamuus voidaan mitata vetyionipotentiaalin mittaustekniikoilla (pH) liuosta. Joissakin pH-analyyttisissä menetelmissä käytetään indikaattoreita, kuten lakmus tai fenolftaleiini, jotka heijastavat liuoksen pH-arvoa värillisenä.
Happoja voidaan luonnehtia:
hapen läsnä ollessa molekyylissä tai ei;
voimalla;
ionisoituvien vetyjen avulla;
sen volatiliteetti.
Lue myös:Happojen ja emästen vertailu - erot ja ominaisuudet
Happojen ominaisuudet
Ne ionisoituvat vesipitoisessa väliaineessa vapauttaen H-kationin+.
Ne ovat sähkönjohtimia johtuen ioneja vesipitoisessa väliaineessa.
Yhteydessä perusympäristöön he kärsivät neutralointireaktiomuodostaen suolaa ja vettä tämän reaktion tuotteina.
Ne muuttavat liuoksen väriä indikaattoriaineen, kuten lakmusin tai fenolftaleiinin, läsnä ollessa.
Sitruunan, appelsiinin, muun sitrushedelmien, hapan maku johtuu näiden elintarvikkeiden haposta.
Vetypotentiaali (pH)
Vetyionipotentiaali (pH) on laskelma, joka ilmaisee
ionipitoisuus vety tietyssä ratkaisu. PH: n määrittämiseksi ja väliaineen analysoimiseksi otetaan huomioon seuraavat:Ostwaldin laimentumislakia (mitä laimennetumpi, sitä enemmän ioneja muodostuu liuoksessa);
veden autoionisaatio (Kw), joka on H-molekyylin luonnollinen hajoaminen2O H-ioneissa+ ja oh-;
tislatulla vedellä 25 ° C: ssa on autoionisaatio Kw = 10-14 ja sama H-ionipitoisuus+ ja oh-eli se on neutraali väliaine.
H-pitoisuutta sisältävän pH-arvon laskemiseksi+, käyttää: pH = -log [H+].
Tietää että:
pH> 7 → emäksinen liuos
pH <7 → hapan liuos
pH = 7 tai pH = pOH → neutraali liuos
Katso myös: Millaiset ovat happokaavat?

Happojen luokitus
THE happoluokitus voidaan tehdä ottaen huomioon neljä erilaista kriteeriä.
Ionisointiaste (α) tai happolujuus
α = ionisoitujen molekyylien lukumäärä
liuenneiden molekyylien lukumäärä
Vahvat hapot: α ≥ 50%.
Esimerkki: áhappo rikkihappo (H2VAIN4) → α = 61%.Puolivahvat tai kohtalaiset hapot: 5% < α < 50%.
Esimerkki: fosforihappo (H3PÖLY4) → α = 27%.Heikot hapot: α ≤ 5%.
Esimerkki: boorihappo (H3BO3) → α = 0,075%.
→ Ionisoituvan vedyn määrä
yksihappoinen: vapauttaa H-kationin+.
Esimerkki: áhappo suolahappo (HCL);
dihappo: vapauttaa kaksi H-kationia+.
Esimerkki: rikkivety (H2S).Triasidi: vapauttaa kolme H-kationia+.
Esimerkki: boorihappo (H3BO3).tetrasidi: vapauttaa neljä H-kationia+.
Esimerkki: pyrofosforihappo (H4P2O7).
Huomio! Happojen tapauksessa kaikki molekyylin vedyt ovat ionisoituvia; mutta oksihappojen tapauksessa vain happiatomiin sitoutuneet vedyt ovat ionisoitavia. Esimerkki on hypofosforihappo (H3PÖLY2), joka on yksihappoinen, koska huolimatta koostumukseltaan kolmesta vedystä se vapauttaa vain vetyä, joka on sitoutunut happi.
→ Hapen läsnäolo
oksihapot: Rakenteessa on happea.
Esimerkki: hypokloorihappo (HO Cl).
Hidrasidit: Rakenteessa ei ole happea.
Esimerkki: fluorivetyhappo (HF).
→ Volatiliteetti
Kiinteä: kiehumispiste(JALKA) > 100 ° C, muuttuu hitaasti kaasumaiseksi tilaksi.
Esimerkki: rikkihappo (H2VAIN4) → PE = 340 ° C.haihtuvat aineet: kiehumispiste <100 ° C, muuttuu nopeasti ja helposti kaasumaiseksi.
Esimerkki: rikkivety (H2S) → PE = -59,6 ° C.
Happojen nimikkeistö
→ Hydridit
Happo + anionin nimi + vesipitoinen
Kaikille hapoille termiä "happo" käytetään ennen molekyyliä kuvaavaa nimikkeistöä. Hapoissa alkuaineen nimen loppuliite "eto" korvataan sanalla "hydric".
Esimerkkejä:
HCl → happo kloorivesipitoinen
HBr → happo bromivesipitoinen
HF → happo fluorivesipitoinen
→ oksihapot
Happojen nimikkeistö vaihtelee hapetusnumero (NOX) keskeisen elementin. Katso alla oleva taulukko:
Keskeisen elementin NOX |
Happojen nimikkeistö |
||
etuliite- |
-lisäosa- |
-liite |
|
+1 ja +2 |
Virtahepo- |
-anionin nimi- |
-oso |
+3 ja +4 |
-- |
Anionin nimi- |
-oso |
+5 ja +6 |
-- |
Anionin nimi- |
-ic |
+7 |
Per |
-anionin nimi- |
-ic |
Esimerkkejä:
HClO → Kun tiedetään, että vedyllä (H) on normaalisti NOX +1 ja hapessa (O) on NOX -2, kloorilla (Cl) täytyy olla NOX +1, joten kloorilla (Cl) on oltava NOX +1, joten tämän hapon nimikkeistö on hypokloorihappo.
HNO2 → typpihappo
HClO4 →áhappoperkloorinen
→ Poikkeukset säännöstä
H2CO3 → hiilihappo, eikä hiilipitoista, kuten se olisi NOX-säännön alaisena.
H3BO3 → áhappo boorinen, eikä tylsää.
Hapot jokapäiväisessä elämässä
Lannoitteet ja lääkkeet: Fosforihappo (H3PÖLY4) käytetään laajalti lannoitteiden valmistuksessa ja myös lääkkeinä. Se on yksi monista lääkealalla käytettävistä hapoista.
Sitrushedelmät: sinulla on askorbiinihappo (C6H8O6), tunnetaan myös C-vitamiini.
Etikka: on koostumuksessaan Etikkahappo (CH3COOH).
- Kuohuvesi ja virvoitusjuomat: koostuu hiilihaposta (H2CO3), joka antaa tuotteelle virkistävän tunteen.
Pääsy myös:Happojen rooli virvoitusjuomissa

ratkaisi harjoituksia
Kysymys 1 - (Enem) Punakaalista uutettua mehua voidaan käyttää indikaattorina eri liuosten happomerkistä (pH 0 - 7) tai emäksisestä (pH 7 - 14). Sekoittamalla vähän kaalimehua ja liuosta seos alkaa näyttää eri väreiltä happaman tai emäksisen luonteensa mukaan alla olevan asteikon mukaan.
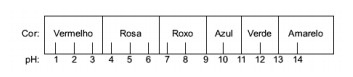
Joitakin ratkaisuja testattiin tällä indikaattorilla, jolloin saatiin seuraavat tulokset:
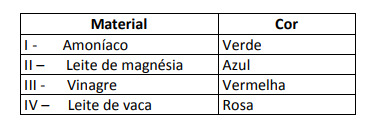
Näiden tulosten mukaan ratkaisuilla I, II, III ja IV on vastaavasti seuraava luonne:
A) hapan / emäksinen / emäksinen / hapan.
B) happo / emäksinen / happo / emäksinen.
C) emäksinen / hapan / emäksinen / hapan.
D) happo / happo / emäksinen / emäksinen.
E) emäksinen / emäksinen / happo / happo.
Resoluutio
Vaihtoehto E. Sen määrittämiseksi, onko aineella hapan, emäksinen vai jopa neutraali luonne, analysoidaan testissä saadut värit suhteessa annetun asteikon tietoihin. Kun tiedämme, että liuokset, joiden pH = 7, ovat neutraaleja, pH> 7 ovat emäksisiä ja pH <7 ovat happamia, saavutamme johtopäätös, että ammoniakki ja magnesiumoksidimaito ovat perusaineita, etikka ja lehmänmaito ovat happoja.
Kysymys 2 - (PUC-Camp) Happoiksi kutsuttujen aineiden osalta opiskelija pani merkille seuraavat ominaisuudet:
Minulla on syövyttävä voima;
II - pystyvät neutraloimaan emäkset;
III - koostuvat kahdesta kemiallisesta alkuaineesta;
IV - muodostavat vesiliuoksia, jotka johtavat sähkövirtaa.
Hän teki virheitä VAIN sisään
A) I ja II
B) I ja III
C) I ja IV
D) II ja III
E) III ja IV
Resoluutio
Vaihtoehto B. Kaikki hapot eivät ole syövyttäviä, vain vahvimmat, ja hapot voivat koostua kahdesta tai useammasta atomista.
kirjoittanut Laysa Bernardes
Kemian opettaja
