Yksi saman liuenneen aineen liuosten sekoittaminen ilman kemiallista reaktiota se koostuu kahden liuoksen yhdistämisestä samaan astiaan esimerkiksi kaliumkloridin (Kcl) kanssa. Tämän tyyppisessä seoksessa ei koskaan tapahdu kemiallista reaktiota johtuen yhtäläisten liuenneiden aineiden läsnäolosta, toisin sanoen molemmilla on sama kationi ja sama anioni. Siten voimme sanoa, että kun teemme seoksen, jolla on nämä ominaisuudet, lisäämme vain liuenneen aineen ja liuottimen määrät, jotka muodostavat molemmat liuokset.
Jos sekoitetaan esimerkiksi liuos, jossa on 1 litra vettä ja 4 grammaa KI: tä (kaliumjodidia) toisen 2 litran vesiliuoksen ja 6 gramman KI: n kanssa, saamme uuden liuoksen, jossa on 3 litraa vettä ja 10 grammaa KI: tä. .
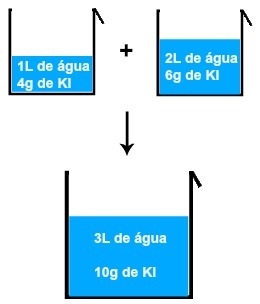
Kahden kaliumjodidiliuoksen sekoittamisen tulos
Analysoimalla kuvaa voimme tehdä sen liuenneen aineen massa (m1Ensimmäisen liuoksen liuos lisätään liuenneen aineen massaan (m1'') toisen ratkaisun, jolloin saadaan liuenneen aineen massa (mF) lopullisessa ratkaisussa (Sekoita):
m1'+ m1'' = mF
Esimerkissä:
4 + 6 = 10 grammaa
Sama tapahtuu jokaisessa liuoksessa olevan vesimäärän kanssa, toisin sanoen toisen (V ') tilavuuteen lisätyn ensimmäisen (V') tilavuus johtaa lopulliseen tilavuuteen (V 'F):
V '+ V' '= VF
Esimerkissä:
1 + 2 = 3 l
Koska jokaisessa liuoksessa on määrä liuenneita aineita ja tässä meillä on seos saman liuenneen aineen liuoksia, voimme sitten edellä esitetystä määrittää kunkin sekoitetun liuoksen ja myös lopullisen liuoksen konsentraation (yhteisen, molaarisuuden).
Siksi meidän on muistettava kaavat näiden pitoisuuksien laskemiseksi:
Yleinen pitoisuus:
C = m1
V
m1 = liuenneen aineen massa
V = liuoksen tilavuus
MERKINTÄ: eristämällä m1 kaavassa meillä on: m1 = CV
Molaarisuus:
M = m1
M1.V
M1 = liuenneen aineen moolimassa.
MERKINTÄ: eristämällä m1 kaavassa meillä on: m1 = M.M1.V
Koska saman liuenneen aineen liuosten seos käsittelee liuenneen aineen massan summan, voimme korvata kaikki havainnot seuraavalla lausekkeella:
m1'+ m1'' = mF
C'.V '+ C' '. V' '= CF.VF
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
C '= liuoksen 1 yleinen pitoisuus
C '' = liuoksen 2 yhteinen pitoisuus
Jos liuoksen seoksen laskemiseen liittyy molaarisuus:
m1'+ m1'' = mF
M'.V '+ M' '. V' '= MF.VF
MERKINTÄ: Koska liukeneva aine on sama, moolimassa on sama jokaisessa liuoksessa; siksi se jätetään huomiotta laskennassa.
nyt katso esimerkkejä, jotka kattavat laskelmat saman liuenneen aineen liuosten seoksessa ilman kemiallista reaktiota:
Esimerkki 1: (Mackenzie-SP-Adaptada) Lisäämällä 600 ml 14 g / l KOH-liuosta tiettyyn tilavuuteen (v) saman emäksen 84 g / l -liuosta saadaan 67,2 g / l -liuos. Lisätty tilavuus (v) 84 g / l liuoksesta on:
a) 0100 ml
b) 3000 ml
c) 2700 ml
d) 1500 ml
e) 1900 ml
Harjoituksen toimittamat tiedot olivat:
V '= 600 ml
C '= 14 g / l
V '' =?
C '' = 84 g / l
VF = ?
CF = 67,2 g / l
Ennen kuin määritetään lisätyn liuoksen 1 tilavuus, meidän on ensin määritettävä lopullinen tilavuus seuraavan lausekkeen avulla:
V '+ V' '= VF
600 + V '' = VF
Korvaamalla alla olevassa matemaattisessa lausekkeessa annetut arvot meillä on:
C'.V '+ C' '. V' '= CF.VF
14. 600 + 84.V '' = 67.2. (600 + V '')
8400 + 84 V '' = 67,2. 600 + 67,2 V ''
8400 + 84.V '' = 40320 + 67.2.V ''
84.V '' - 67.2.V '' = 40320-8400
16,8 V '' = 31920
V '' = 31920
16,8
V '' = 1900 ml
Esimerkki 2: (UFOP) 1000 ml: n mittapulloon lisättiin 250 ml 2 M rikkihappoliuosta 300 ml: n kanssa saman hapon 1 M liuosta ja tilavuus täytettiin 1000 ml: aan tislattua vettä. Määritä tuloksena olevan liuoksen molaarisuus.
Harjoituksen toimittamat tiedot olivat:
V '= 250 ml
M '= 2 M
V '' = 300 ml
M '' = 1 M
VF = 1000 ml
MF = ?
Käytä lopullisen liuoksen molaarisuuden määrittämiseen vain prosessia edustavaa matemaattista lauseketta:
M'.V '+ M' '. V' '= MF.VF
2. 250 + 1. 300 = MF.1000
500 + 300 = MF. 1000
800 = MF
1000
MF = 0,8 mol / l
Minun luona. Diogo Lopes Dias
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
PÄIVÄT, Diogo Lopes. "Yhden liuenneen aineen seos ilman kemiallista reaktiota"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/mistura-solucoes-mesmo-soluto-sem-reacao-quimica.htm. Pääsy 27. kesäkuuta 2021.