Ideoita aineen (atomin) rakenteesta syntyi muinaisessa Kreikassa, noin 450 eKr. a., lähinnä Democritosta ja Leuciposta. Atomi sai kuitenkin tieteellisen luonteen vasta ns Daltonin atomiteoria.
THE Daltonin atomiteoria se oli perusta atomitiedon kehitykselle, koska se toimi perustana muille tutkijoille atomin ja sen ominaisuuksien tuntemiseen.
Kuka oli John Dalton?
Koulutukseltaan kemisti John Dalton syntyi Cumbriassa Englannissa vuonna 1766 ja kuoli Manchesterissa vuonna 1844. Varhaisesta iästä lähtien hänen elämänsä oli suunnattu tieteelliseen tutkimukseen ja opettamiseen niin paljon, että hän opetti tai osallistui eri osa-alueiden kehittämiseen.
Hänen suurin perintö tiedemiehenä oli kuitenkin ensimmäisen atomiteorian kehittäminen. Daltonin atomiteoria syntyi vuonna 1808 useiden kaasujen seokseen liittyvien kokeiden ja Lavoisier'n ehdottamien teosten tuntemuksen kautta.
Daltonin atomiteorian postulaatit
Daltonin atomiteoria perustui kokeisiin, mutta mikään näistä kokeista ei voinut paljastaa atomia selvästi. Siksi Dalton kutsui atomia aineen pienimmäksi osaksi.
Daltonin teoria esittää paljon enemmän postulaatteja kuin todisteita. Katso joitain heistä:
Atomit ovat massiivisia ja pallomaisia (samanlaisia kuin biljardipallo);
Atomit ovat jakamattomia;
Atomit ovat tuhoutumattomia;
Yksi kemiallinen alkuaine se on joukko atomeja, joilla on samat ominaisuudet (koko ja massa);
Eri kemiallisten alkuaineiden atomeilla on erilaiset ominaisuudet;
Kahden atomin suhteellista painoa voidaan käyttää niiden erottamiseen;
Yhdistetty kemikaali muodostuu samasta yhdistelmästä erityyppisiä atomeja;
Erilaisia kemiallisia aineita muodostuu yhdistämällä erilaisia atomeja.
Daltonin atomimallin esitykset
Dalton nimesi atomimallinsa biljardipalloksi ja alkoi siksi edustaa aikanaan tunnettujen alkioiden atomeja pallomaisilla symboleilla.
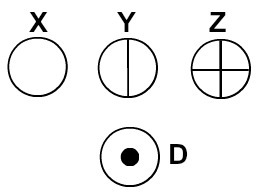
Atomit edustettuina Daltonin atomiteorian mukaan
Jokainen atomiesitys, jolla on erityinen yksityiskohta, osoittaa eri kemiallisen elementin. Didaktisesti alkeis- ja keskitason kirjat ja harjoitukset edustavat atomeja vain eri väreillä.
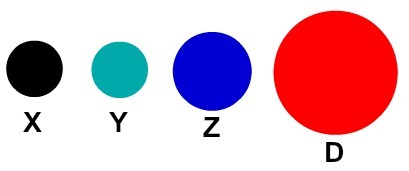
Atomien didaktinen esitys
Daltonin atomiteorian vaikutukset
ymmärrys Lavoisierin laki massan säilyttämisestä
Ranskalainen kemisti Lavoisier väitti vuonna 1785, että "Kemiallisessa reaktiossa massa säilyy, koska atomeja ei synny eikä tuhoa ”. Daltonin atomiteoria osoitti tämän tosiasian, koska yksi hänen postulaatistaan totesi atomin olevan tuhoutumaton.
Siksi, jos suoritamme kivihiilen (C) polttamisen happikaasun (O2), meillä on kemiallinen reaktio yhden hiiliatomin ja kahden happiatomin välillä. Tämä reaktio muodostaa hiilidioksidia (CO2), jossa on täsmälleen samat atomit kuin aineissa ennen reaktiota.
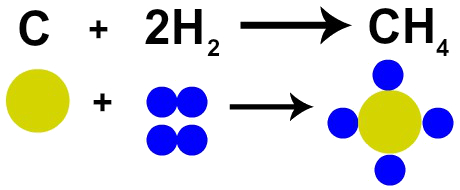
Lavoisierin lain esitys Daltonin atomimallilla
ymmärrys yksinkertaiset aineet
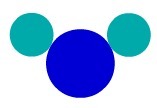
Käyttämällä Daltonin atomimalli, voimme ymmärtää yksinkertaisen aineen, toisin sanoen sellaisen, jolla on saman ominaisuuden atomeja, jotka muodostavat molekyylin. Siksi meillä on atomeja, jotka kuuluvat samaan kemialliseen elementtiin.
Aine F2Esimerkiksi meillä on kaksi fluoriatomia, joten meidän on käytettävä kahden tyyppisiä samanlaisia atomeja esityksessä Daltonin atomiteorian mukaisesti.

Yksinkertainen aineen esitys Daltonin atomimalli
ymmärrys yhdisteaineet
Yhdisteaineessa molekyylin muodostavat atomit, joilla on erilaiset ominaisuudet. Siksi meillä on erilaisia kemiallisia alkuaineita, jotka muodostavat aineen.
Aine H2Esimerkiksi O: lla on kolme atomia: kaksi vetyä ja yksi happi. Katso sen esitys Daltonin atomimallin mukaan:
Yhdistetyn aineen kuvaus ihon mukaanDaltonin atomimalli
Seosten ymmärtäminen
Seoksen (kahden tai useamman eri aineen yhdistyminen) ymmärtäminen Daltonin atomiteorian kautta on yksinkertaista: laita vain kaksi erilaista molekyyliä samaan astiaan.

Toisen seoksen esitys Daltonin atomimalli
John Daltonin muut tieteelliset kommentit
esitteli atomimassa;
Muotoili laki kaasujen osapaineista (Daltonin laki);
Löysi näkövamma kutsutaan Värisokeus;
Tutkittu höyryjen ja kaasujen käyttäytymistä eri lämpötiloissa;
Hän havaitsi, että kaikki kaasut laajenevat (he yrittävät miehittää tietyn paikan) avaruudessa samalla tavalla.
Minun luona. Diogo Lopes Dias
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/teoria-atomica-dalton.htm
