tapahtuu muutosisokoorinen kun tietyllä kaasumassalla tapahtuu muutoksia lämpötila jotka laukaisevat paineen muutokset tai päinvastoin, kun otetaan huomioon lämpötila ja paineovat tässä tapauksessa suoraan suhteellisia määriä, kun taas järjestelmän tilavuus pysyy muuttumattomana.
Katso myös: Mikä on kaasujen osapaine?
Mikä on isokoorinen muutos?
Isokoorinen muunnos on, kun lämpötilan ja paineen muutos tapahtuu tietylle kaasumassalle, mutta sen tilavuus pysyy samana. Paineen muutos on suoraan verrannollinen lämpötilaaneli jos kaasu kaksinkertaistaa tietyssä suljetussa järjestelmässä absoluuttisen lämpötilan, se aiheuttaa paineen nousun kaksinkertaiseksi alun perin.
Tämän tyyppistä muunnosta kutsutaan myös isovolumetrinen tai isometrinen. Isokoorinen termi tulee kreikan kielestä Isokhora, mistä iso tarkoittaa "yhtä" ja khora tarkoittaa "paikka tai tilavuus" (tässä yhteydessä).
Esimerkkejä:
Auton renkaat muuttuvat isokoorisesti, voimme havaita tämän, kun teemme sen kalibrointi. Kuumina päivinä kalibrointimonitorissa annettu paine on korkeampi kuin kylminä päivinä. Tämä johtuu siitä, että lämpötilan noustessa paine kasvaa, koska tilavuus pysyy.

Muita esimerkkejä ovat spray-deodorantit, tämäntyyppisissä tuotteissa etiketissä on varoitus, ettei niitä saa säilyttää tai altistaa korkeille lämpötiloille, koska sen lisäksi, että jotkut sen aineet ovat syttyviä, on isohorisen muutoksen tai isovolumetrinen. Koska aerosolidodorantit ovat suljetussa pullossa ja kaasumaisessa tilassa, lämpötilan nousu johtaa paineen nousuun ja räjähdysvaaraan.
Isokoorisen muunnoksen ominaisuudet
- Jatkuva äänenvoimakkuus.
- Paine ja lämpötila ovat suoraan verrannollisia.
Nämä ominaisuudet voidaan kuvata seuraavilla kaavoilla:

Kaavio isokoorisesta funktiosta
Huomaa seuraava taulukko, joka kuvaa kaasun käyttäytymistä suhteessa paineeseen, lämpötilaan ja tuloksena olevaan vakioon.
Lämpötila (° C) |
Paine (atm) |
P / T = vakio |
50 |
5 |
10 |
100 |
10 |
10 |
150 |
15 |
10 |
200 |
20 |
10 |
Huomaa, että paine seuraa lämpötilan nousua niin, että P / T-suhde pysyy vakiona, mikä tarkoittaa, että paine ja lämpötila ovat suoraan verrannollisia määriä. Siksi isokhorisia transformaatioita kuvaava kaavio on lineaarinen. Katso:

Kuka löysi isokoorisen muutoksen?
Jacques Alexandre César Charles (1746-1823) oli ranskalainen tiedemies, joka tutkien kaasujen käyttäytymistä suljetussa järjestelmässä tarkkuuslämpömittarin luomiseksi, saattoi päätökseen tutkimukset isokoorisista muutoksista.
Tiedemies Joseph Louis Gay-Lussac (1778-1850) kehitti myös tutkimuksen kaasumaisen järjestelmän laajenemisesta ja kutistumisesta. Nämä olivat itsenäisiä analyysejä, mutta koska ne päätyivät samaan johtopäätökseen, he jakoivat hyvitykset. Nykyään jotkut kirjoittajat viittaavat kahteen viimeiseen fyysiseen lakiin, jotka selittävät kaasua isobaariset muunnokset ja isokoorisia Charles-Gay-Lussacin 1. ja 2. laki.
Katso myös: Gay-Lussacin mittalaki
Harjoituksetratkaistu
Kysymys 1 - (PUC-RJ) Polkupyörän rengas kalibroidaan 4 atm: n paineessa kylmänä päivänä 7 ° C: n lämpötilassa. Ruiskutetun kaasun tilavuus ja määrä ovat samat. Mikä on renkaan kalibrointipaine, kun lämpötila saavuttaa 37 ° C?
a) 21,1 atm
b) 4,4 atm
c) 0,9 atm
d) 760 mmHg
e) 2,2 atm
Resoluutio
Vaihtoehto A
1. vaihe: tunnista järjestelmä ja poimi tiedot.
Isovolumetrinen järjestelmä
P1 = 4 atm
T1 = 7 ° C
T2 = 37 ° C
P2 =?
Kaavan avulla:
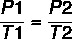
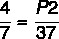
7 x P2 = 37 x 4
P2 = 148/7
P2 = 21,14 atm
Kysymys 2 - (Unifor-CE) Tutki alla olevaa kuvaa.
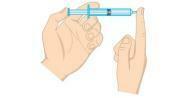
Ruiskun sisällä olevaa kaasupainetta voidaan laskea:
a) asettamalla ruisku jääveteen pitäen sen päätä suljettuna.
b) puristamalla mäntää pitämällä päätä suljettuna.
c) ruisku asetetaan kuumaan veteen pitäen pää suljettuna.
d) avaamalla kärki ja poistamalla puolet ilmasta ruiskusta.
e) vetämällä mäntää pitämällä pää auki.
Resoluutio
Vaihtoehto A. Kaasun paine on suoraan verrannollinen lämpötilaan isokoorisessa järjestelmässä, toisin sanoen muuttamatta kaasun tilavuutta tai massaa. Kun lämpötila laskee, paine laskee myös.
Kirjoittanut Laysa Bernardes Marques de Araujo
Kemian opettaja
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/transformacao-isocorica.htm
