Jos käytämme volttimittaria akussa, pystymme tunnistamaan potentiaalin (U tai ddp) tai sähkömoottorin voiman (emf tai E) eron kahden elektrodin välillä. Kunkin elektrodin pelkistys- tai hapetuspotentiaalia ei kuitenkaan ole mahdollista tunnistaa tällä tavalla.
Tutkijoiden oli tiedettävä nämä arvot hapettumis-pelkistysprosessien tutkimiseksi, joten he perustivat a viitetila. Tämä tarkoittaa, että sovittiin mittaamaan kunkin elektrodin potentiaali suhteessa toiseen elektrodiin seuraavissa vakio-olosuhteissa:
• Lämpötilan on oltava 25 ° C;
• Paine 1,0 atm;
• Liuoksen, johon metalli upotetaan, on oltava 1,0 mol / l.
Siten valittu elektrodi oli vetyelektrodi, joka on esitetty alla:
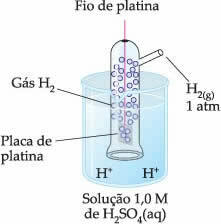
Tämä elektrodi koostuu platinalevystä, joka on kytketty platinalevyyn, joka ei osallistu reaktioon, vetykaasua sisältävän putken sisällä ja upotettuna happamaan liuokseen. Esimerkissä liuos oli rikkihappo.
| Sopimuksella standardille vetyelektrodille on annettu arvo nolla, niin paljon E: stä0punainen kuten E: lle0oksi. |
Siten minkä tahansa muun elektrodin potentiaaliarvon selvittämiseksi rakennamme vain pinon haluamastamme elektrodista tavallisella vetyelektrodilla ja mitataan ddp voltimittarilla. Jännitemittarilla näkyvä arvo on etsittävän elektrodin potentiaali, koska vedyn arvo on nolla.
Yhdistämme esimerkiksi sinkkielektrodin vetyelektrodin kanssa selvittääkseen, mikä on sen pelkistyspotentiaali:
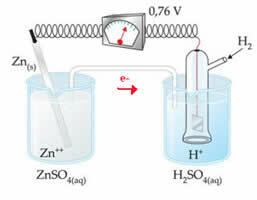
Yllä olevan kaavion mukaan voltimittari tunnisti potentiaalieron olevan yhtä suuri kuin +0,76 (aE0 = +0,76). Huomaamme myös, että sinkkielektrodi on hapettunut, joten se on anodi; ja vetyelektrodi pelkistetty, mikä on katodi.
Joten meillä on:
? E0 = E0red (katodi) - E0 punainen (anodi)
0,76 = 0,00 - E0 punainen (Zn)
E0 punainen (Zn) = 0,00-0,76
E0 punainen (Zn) = -0,76
Negatiivinen arvo tarkoittaa, että elektronivirta virtaa sinkkielektrodista (anodista) vetyelektrodiin käyttäytyen siten kuin katodi. Jos se olisi positiivinen, se olisi päinvastoin, ja vetyelektrodi käyttäytyisi kuin anodi. Tämä näkyy, kun yhdistämme kuparielektrodin tavalliseen vetyelektrodiin:
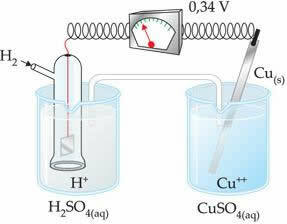
? E0 = E0red (katodi) - E0 punainen (anodi)
-0,34 = 0,00 - E0 punainen (Zn)
E0 punainen (Zn) = 0,00 + 0,34
E0 punainen (Zn) = +0,34
Siten on mahdollista määritellä pelkistys- ja hapettumispotentiaalit kaikkein vaihtelevimmille kemiallisille lajeille. Kansainvälinen puhtaan ja sovelletun kemian liitto (IUPAC) suosittelee kuitenkin vain pelkistyspotentiaalien käyttöä. Ja käytetystä metallista riippumatta, vetyelektrodi on aina akun esityksessä ensin, esimerkiksi:
Pt - H2 (g) 1atm / H3O1 + (vesiliuos) 1 mol / L // Cu2 + (vesipitoisuus) 1 mol / L / Cu
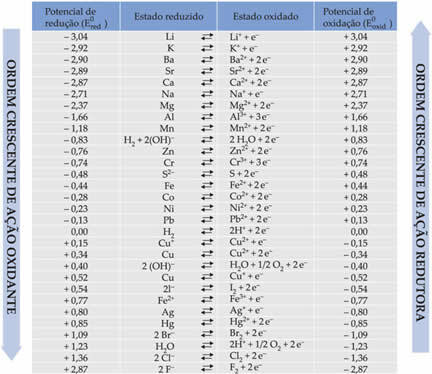
Alla olevassa taulukossa on lueteltu tällä tavanomaisen vetyelektrodin käyttötavalla saavutetut potentiaalit sekä niiden vastaavat puolireaktiot:
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Brasilian koulutiimi
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/medicao-dos-potenciais-eletroquimicos.htm
