Koska orgaanisia yhdisteitä on tuhansia, isomerismin ilmiö voi olla monenlaisia. Siksi isomerismi voidaan periaatteessa luokitella kahteen tyyppiin: tasainen tai perustuslaillinen isomerismi ja avaruuden isomerismi tai stereoisomeeri. Jokainen mainittu tyyppi voidaan jakaa osiin seuraavan kaavion mukaisesti:
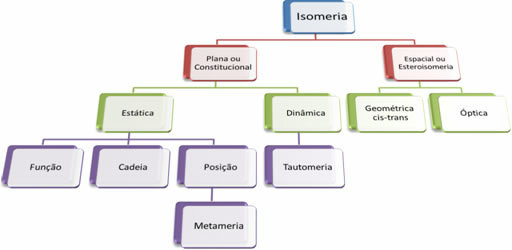
Katso jokainen tapaus:
1. Tasainen tai perustuslaillinen isomeria: Tämän tyyppisillä isomeereillä on sama molekyylikaava ja ne erotetaan tasaisilla rakennekaavoilla. Tasoisomeriaa on viisi: toiminto, ketju, asema, metamerismi ja tautomerismi.
1.1.Toiminnallinen tai toiminnallinen isomerismi: Ero isomeerien välillä on funktionaalisessa ryhmässä.
Esimerkki: Molekyylikaava C3H6O
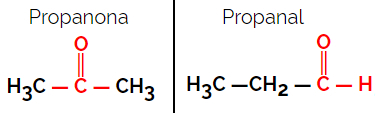
Huomaa, että propanoni on ketoniryhmästä ja propanaali aldehydiryhmästä.
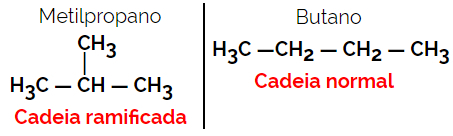
1.2. Ketju- tai luuston isomeerit: Isomeerien ero on ketjutyypissä. Esimerkiksi yksi isomeeri on avoimen ketjun ja toinen suljetun ketjun tai yksi on normaaliketjuinen ja toinen haarautunut ketju tai toinen on homogeeninen ketju ja toinen on heterogeeninen ketju.
Esimerkki: Molekyylikaava C4H10
1.3.Asento- tai sijainti-isomeria: Ero on tyydyttymättömyyden, funktionaalisen ryhmän, heteroatomin tai substituentin asemassa.
Esimerkki: Molekyylikaava C4H6

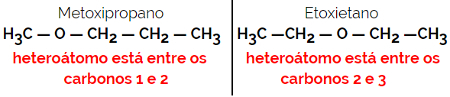
1.4.Kompensointi-isomeria tai metamery: Se on erityinen asema-isomerismi, jossa ero on heteroatomin sijainti.
Esimerkki: Molekyylikaava C4H10O
1.5.Dynaaminen isomery tai tautomery: Se on erityinen funktionaalinen isomerismi, jossa isomeerit esiintyvät rinnakkain liuoksen dynaamisessa tasapainossa. Tautomerian kaksi päätyyppiä ovat ketonin ja enolin (ketoenolitasapaino) ja aldehydin ja enolin (aldoenolitasapaino) välillä.
Esimerkki: Molekyylikaava C3H6O
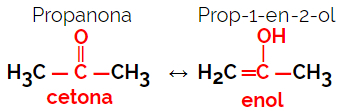
2. Avaruusisomeria tai -steroisomerismi: Tässä tapauksessa isomeerien välinen ero voidaan visualisoida vain niiden atomien suunnan kautta avaruudessa. Stereoisomeeria on kahta tyyppiä: geometrinen isomeeri ja optinen isomerismi.
2.1.Geometriset tai cis-trans-isomeerit: Ero on siinä, että isomeeri on nimetty IVY sillä on samat hiililigandit kaksoissidoksessa tai syklisissä yhdisteissä tason samalla puolella. Isomeeriligandit kään ovat vastakkaisilla puolilla.
Esimerkki: Molekyylikaava C2H2Cl2

Näitä yhdisteitä kutsutaan stereoisomeerit.
2.2.Optinen isomeeri: Toimii, kun isomeerit kykenevät taipumaan polarisoidun valonsäteen. Jos se taivuttaa polarisoidun valonsäteen vasemmalle, se on levorotary isomeeri, mutta jos se taipuu oikealle, sitä kutsutaan oikeakätiseksi isomeeriksi.
Esimerkki:
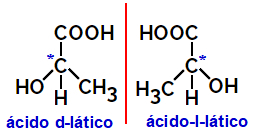
Edellä esitettyjen kaltaisia epäsymmetrisiä molekyylejä, jotka ovat peilikuvia toisistaan ja jotka eivät ole päällekkäisiä, kutsutaan enantiomeerit.
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm

