meillä on liuosten sekoittaminen erilaisten liuenneiden aineiden kanssa ilman kemiallista reaktiota kun kaksi tai useampia seoksia, joilla on aineita, joilla on sama ioni (joko sama kationi tai sama anioni). Kuten alla olevassa esimerkissä:
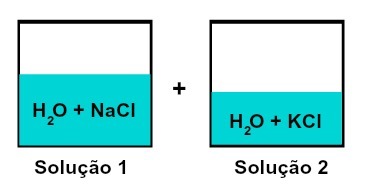
Seos liuoksia, joilla on erilaisia liuenneita aineita
Liuos 1 on vesi ja natriumkloridi (NaCl), kun taas liuoksessa 2 on vettä ja kaliumkloridia (KCl). Kun sekoitetaan yhteen, meillä on erilaisten liuenneiden liuosten sekoittaminen ilman kemiallista reaktiota, koska molemmilla käytetyillä suoloilla on kloridianioni (Cl-).
1 - Eri liuenneiden liuosten seokset ilman kemiallista reaktiota
Kun suoritetaan seos liuoksia, joissa on erilaisia liuenneita aineita ilman kemiallista reaktiota, alla olevat ominaisuudet tarkistetaan aina:
Kummankin liuenneen aineen massa ei muutu (jos liuoksessa 1 meillä on 10 g liuennutta ainetta ja esimerkiksi 2, 30 g: ssa sekoittamisen jälkeen, meillä on sama massa kutakin liuotettua ainetta),
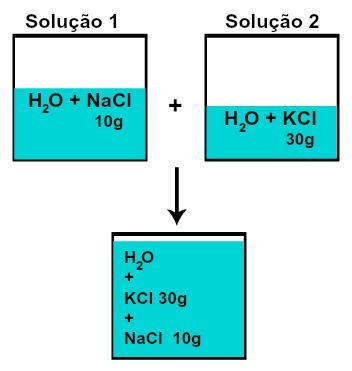
Kunkin liuenneen aineen massa liuosten sekoittamisen jälkeen ilman kemiallista reaktiota
THE aineen määrä (n) kumpaakaan liuenneesta aineesta ei muutu (jos liuoksessa 1 meillä on 5 mol liuotinta ja esimerkiksi 2, 4 mol, sekoituksen jälkeen meillä on sama määrä ainetta kutakin),
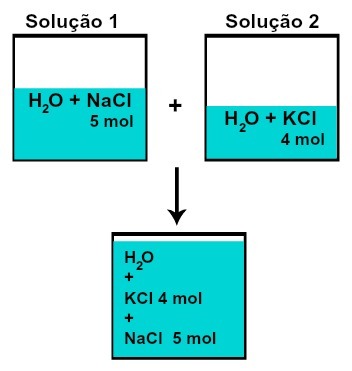
Kunkin liuenneen aineen moolien määrä liuosten sekoittamisen jälkeen ilman kemiallista reaktiota
Lopullisen liuoksen tilavuus VF, on tulos sekoitettujen liuosten tilavuuksien summasta (jos liuoksessa 1 meillä on 200 ml ja liuoksessa 2 esimerkiksi 300 ml, sekoituksen jälkeen meillä on 500 ml tilavuutta),
VF = V1 + V2
2- Kaavat, joita käytetään laskettaessa eri liuenneiden aineiden liuosten sekoittamista ilman kemiallista reaktiota.
Kuten tämän tyyppisessä seoksessa, liuottimen määrä kasvaa vain suhteessa kuhunkin liuenneet aineet, meidän on laskettava kunkin liuenneen aineen lopullinen pitoisuus seuraavien avulla lausekkeet:
a) Vastaanottaja yhteinen pitoisuus (Ç)
Liuokselle 1: liuoksen 1 pitoisuuden kertominen tilavuudella on yhtä suuri kuin lopullinen pitoisuus kerrottuna sen tilavuudella
Ç1.V1 = CF.VF
Liuokselle 2: liuoksen 2 pitoisuuden kertominen tilavuudella on yhtä suuri kuin lopullinen pitoisuus kerrottuna sen tilavuudella
Ç2.V2 = CF.VF
b) Vastaanottaja pitoisuus aineen määrässä tai molaarisuus (M)
Ratkaisulle 1:
M1.V1 = MF.VF
Ratkaisulle 2:
M2.V2 = MF.VF
c) Jokaisen liuoksessa olevan ionin pitoisuus ainemäärinä
Jos meidän on määritettävä yhden tai kaikkien lopullisessa liuoksessa olevien ionien pitoisuus, meidän on:
1º: Muista, että ionipitoisuus saadaan kertomalla sen liuenneen aineen pitoisuus (M) sen indeksillä aineen kaavassa. Joten ionille Y, aineessa 1, XY3, pitoisuus on:
[Y]1 = 3. M
Mitä tulee liuenneeseen aineeseen 2, ZY, Y: n pitoisuus saadaan seuraavasti:
[Y]2 = 1. M
2º: Jos meillä on useampi kuin yksi liuotin, joka vapauttaa saman ionin, esimerkiksi XY3 ja ZY, joilla on sama ioni Y, tämän ionin pitoisuus lopullisessa liuoksessa saadaan sen pitoisuuksien summalla kullekin liuenneelle aineelle:
[Y]F = [Y]1 + [Y]2
3- Esimerkkejä laskelmista, joissa sekoitetaan erilaisia liuenneita aineita ilman kemiallista reaktiota
Esimerkki 1: (PUC SP) Dekantterilasissa sekoitettiin 200 ml kalsiumkloridin (CaCl) vesiliuosta2), jonka pitoisuus on 0,5 mol. L–1 ja 300 ml 0,8 mol-liuosta. L–1 natriumkloridia (NaCl). Saadun liuoksen kloridianionipitoisuus on noin:
a) 0,34 mol. L–1
b) 0,65 mol. L–1
c) 0,68 mol. L–1
d) 0,88 mol. L–1
e) 1,3 mol. L–1
Harjoituksen toimittamat tiedot olivat:
Ratkaisu 1:
Äänenvoimakkuus (V1): 200 ml
Moolikonsentraatio (M1): 0,5 mol. L–1
Ratkaisu 2:
Äänenvoimakkuus (V2): 300 ml
Moolikonsentraatio (M2): 0,8 mol. L–1
Kloridianionien (Cl-), meidän on noudatettava näitä vaiheita:
Vaihe 1: lasketaan lopullisen liuoksen tilavuus
VF = V1 + V2
VF = 200 + 300
VF = 500 ml
Vaihe 2: Laske lopullisen liuoksen moolipitoisuus suhteessa CaCl-liuenneeseen aineeseen2käyttäen seuraavaa ilmaisua:
M1.V1 = MF.VF
0,5 200 = MF.500
100 = MF.500
100 = MF
500
MF = 0,2 mol. L–1
Vaihe 3: Laske kloridin moolipitoisuus [Cl-]1lopullisessa liuoksessa CaCl-liuenneesta aineesta2käyttäen seuraavaa ilmaisua:
MERKINTÄ: Kaavassa kerrotaan molaarisuus 2: lla, koska Cl: ssä on indeksi 2, liuenneessa kaavassa CaCl2.
[Cl-]1 = 2.MF
[Cl-]1 = 2. 0,2
[Cl-]1 = 0,4 mol. L–1
Vaihe 4: Laske lopullisen liuoksen moolipitoisuus suhteessa NaCl-liuenneeseen aineeseen käyttäen seuraavaa ilmaisua:
M2.V2 = MF.VF
0,8,300 = MF.500
240 = MF.500
240 = MF
500
MF = 0,48 mol. L–1
Vaihe 5: Laske kloridin moolipitoisuus, [Cl-]2lopullisessa liuoksessa NaCl-liuenneesta aineesta käyttäen seuraavaa ilmaisua:
MERKINTÄ: Kaavassa kerrotaan molaarisuus yhdellä, koska Cl: ssä on indeksi 1 liuenneen NaCl: n kaavassa.
[Cl-]2 = 1.MF
[Cl-]2 = 1. 0,48
[Cl-]2 = 0,48 mol. L–1
Vaihe 6: Laske kloridi-ionien kokonaismäärä lopullisessa liuoksessa
Tätä varten lisää vain kloridien moolipitoisuudet kullekin liuenneelle aineelle vaiheissa 3 ja 5:
[Cl-]F = [Cl-]1+ [Cl-]2
[Cl-]F = 0,4 + 0,48
[Cl-]F = 0,88 mol. L–1
Esimerkki 2: Liuokseen, jossa oli 500 ml 6 mol / l KOH: ta, lisättiin 300 ml K-liuosta.2VAIN3 3 mol / l. Mikä on kunkin liuenneen aineen pitoisuus tuloksena olevassa seoksessa
a) 3,75 ja 3,0 mol / l
b) 3,75 ja 1,215 mol / l
c) 4,5 ja 1,125 mol / l
d) 3,75 ja 1,125 mol / l
e) 4,5 ja 1,215 mol / l
Harjoituksen toimittamat tiedot olivat:
Ratkaisu 1:
Äänenvoimakkuus (V1): 500 ml
Moolikonsentraatio (M1): 6 mol. L–1
Ratkaisu 2:
Äänenvoimakkuus (V2): 300 ml
Moolikonsentraatio (M2): 3 mol. L–1
Kloridianionien (Cl-), meidän on noudatettava näitä vaiheita:
Vaihe 1: lasketaan lopullisen liuoksen tilavuus
VF = V1 + V2
VF = 500 + 300
VF = 800 ml
Vaihe 2: Laske lopullisen liuoksen moolipitoisuus suhteessa KOH-liuenneeseen aineeseen käyttäen seuraavaa ilmaisua:
M1.V1 = MF.VF
6500 = MF.800
3000 = MF.800
3000 = MF
800
MF = 3,75 mol. L–1
Vaihe 3: Laske lopullisen liuoksen moolipitoisuus suhteessa liuenneeseen K2VAIN3käyttäen seuraavaa ilmaisua:
M2.V2 = MF.VF
3300 = MF.800
900 = MF.800
900 = MF
800
MF = 1,125 mol. L–1
Minun luona. Diogo Lopes Dias
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/mistura-solucoes-com-solutos-diferentes-sem-reacao-quimica.htm

