Dissosiaatio emäkset se on a fyysinen prosessi - joka tapahtuu tämän tärkeän epäorgaanisten aineiden ryhmän kanssa, kun ne liuotetaan veteen, tai kun ne käyvät läpi fuusioprosessin (siirtyminen kiinteästä tilasta nestemäiseen tilaan läpi lämmitys).
Yleensä ilmiö perusta dissosiaatio se muodostaa kationit ja anionit ioninen yhdiste, joka tässä tapauksessa on perusta. Joten perusta dissosiaatio, julkaisu ioneja joita on jo yhdisteessä, toisin sanoen uusia ioneja ei muodostu.
Emäs muodostuu mistä tahansa metallista (X), joka on yhdisteen kationi, tai ammoniumkationista (NH-ryhmä4+), sitoutuneena hydroksidianioniin (edustaa OH-ryhmä), kuten alla olevissa esityksissä:
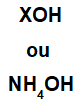
Peruskaavan yleiset esitykset
muodossa edustavat perusta dissosiaatio se tehdään yhtälön avulla, jossa reagenssissa meillä on emäs ja tuotteissa ionit (kationit ja anionit). Ero on siinä, miten dissosiaatio tapahtuu:
Emäksen liukeneminen veteen:
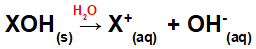
Yhtälö, joka edustaa emäksen dissosiaatiota vesipitoisessa väliaineessa
Irtautuminen perussulautumisella:
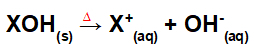
Yhtälö, joka edustaa emäksen dissosiaatiota fuusioprosessilla
Analysoimalla yllä olevat yleiset yhtälöt varmistamme, että meillä kaikilla on aina emäs, kationi (joka on metalli- tai NH-ryhmä4+) ja anioni (OH-). Mutta ovatko he kaikki sellaisia? Eikö niiden välillä ole eroa? Ensimmäiseen kysymykseen vastataan kieltävästi ja toiseen kysymykseen kyllä.
Kun suoritamme dissosiaatio tukikohdasta, on ensiarvoisen tärkeää ensin analysoida peruskaava, koska sen perusteella voimme määrittää kationin ja hydroksidianionien moolimäärä, koska kationin moolimäärä on vakio (aina 1 mol).
On syytä muistaa, että emäskaavassa läsnä olevien OH-ryhmien määrä määrittää kationin varauksen ja hydroksidianionin määrän moolina emäksen dissosiaatiossa.
Katsotaanpa esimerkkejä alumiinihydroksidista [Al (OH)3] ja kultahydroksidi (AuOH). Alumiinipohjakaavassa on kolme OH-ryhmää ja kullan peruskaavassa vain yksi OH-ryhmä. Siten näiden emästen dissosiaatiossa meillä on:
Al (OH) dissosiaatio3:
Koska tällä emäksellä on kaavassa kolme OH-ryhmää, kationin varaus on +3 ja anionien moolimäärä on yhtä suuri kuin 3 mol, kuten voimme nähdä seuraavasta yhtälöstä:
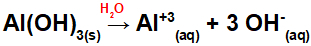
Alumiiniemäksen dissosiaatioyhtälö vesipitoisessa väliaineessa
Eroaminen AuOH: sta:
Koska tällä emäksellä on kaavassa OH-ryhmä, kationin varaus on +1 ja anionien moolimäärä on yhtä moolia, kuten voimme nähdä seuraavasta yhtälöstä:
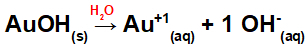
Emäksen dissosiaation yhtälö kullalla vesipitoisessa väliaineessa
Minun luona. Diogo Lopes Dias
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-dissociacao-das-bases.htm


