Voimme huomata sen aina kun nostamme yhden tai kaikkien kemialliseen reaktioon osallistuvien reaktanttien pitoisuutta, sen kehitysnopeus eli reaktion nopeus kasvaa.
Päinvastoin on totta. Esimerkiksi tällä hetkellä suositellaan, että käytämme alkoholigeeliä tavallisen alkoholin sijaan, koska on vähemmän vaaraa palaa ja välttää siten onnettomuuksia. Tavallinen nestemäinen alkoholi on itse asiassa alkoholin ja veden seos, geelialkoholin kanssa, joka sisältää pienemmän määrän alkoholia. Siksi, kun yhden palamisreagenssin pitoisuus pienenee, alkoholin tapauksessa reaktio etenee hitaammin. Toisaalta, mitä puhtaampi alkoholi, sitä nopeampi palamisreaktio.

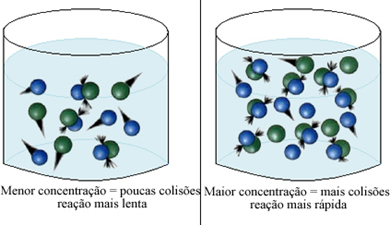
Kuten tekstissä todetaan Edellytykset kemiallisten reaktioiden esiintymiselle, yksi reaktion tapahtumisen ehdoista on tehokas törmäys hiukkasten välillä. Täten, reagenssien pitoisuuden kasvu mahdollistaa suuremman määrän hiukkasia tai molekyylejä suljettuna samaan tilaan. Tämä lisää niiden välisten törmäysten määrää ja lisää myös todennäköisyyttä, että tapahtuu tehokkaita törmäyksiä, jotka johtavat reaktion tapahtumiseen. Tuloksena on, että reaktio tapahtuu nopeammin.
Jos haluat nähdä tämän, ajattele seuraavaa esimerkkiä: kun meillä on palava hiili ja haluamme, että tämä palaminen prosessoituu nopeammin, puhallammeko vai tuuletammeko hiiltä? Miksi tämä toimii?
No, tässä palamisreaktiossa yksi reagoivista aineista on ilmassa oleva happi. Kun ravistelemme, ilmavirta poistaa palamisen aikana muodostuvan tuhkan ja tämä helpottaa hapen kosketusta hiilloksen kanssa. Tällä tavoin lisäämme reaktanttien välistä kosketusta ja nopeutamme palamisreaktiota.
Lyhyesti sanottuna meillä on:

Kaasujen kanssa työskenneltäessä yksi tapa lisätä reagenssien pitoisuutta on laske painetta. Kun teemme tämän, pienennämme tilavuutta ja näin ollen reagenssipitoisuudet kasvavat.

Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm

