Sinä esterit ovat hapetettuja orgaanisia yhdisteitä, jotka muodostuvat a karboksyylihappo se on a alkoholia. Esitä funktionaalinen ryhmä (joka koostuu kahdesta happiatomista ja kahdesta radikaalit R) edustettuina alla:
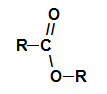
Esterin yleinen funktionaalinen ryhmä
Rakenteellisesti mikä luonnehtii esteri se on jonkin verran happiatomiin sitoutunutta alkyyliradikaalia. Tässä tapauksessa hiileen kiinnittynyt radikaali (R), joka puolestaan on kaksinkertaisesti sitoutunut happeen, voi olla joko alkyyliradikaali tai vetyatomi.
Esterin hiiliketju
esteröintireaktio
se koskee kemiallinen reaktio, joka saa esterin ja vesimolekyylin aikaan karboksyylihapon ja minkä tahansa alkoholin vuorovaikutuksesta, kuten alla olevassa yhtälössä:
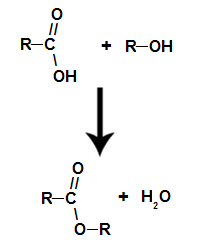
Kemiallinen yhtälö, joka edustaa esterin muodostumista
Esteröinnin aikana alkoholin hydroksyyliryhmä (OH) on vuorovaikutuksessa alkoholin kanssa vety (H) ionisoituva hapon hydroksyylistä ja muodostaa vesimolekyyli.
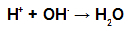
Vesimolekyylin muodostavat ryhmät esteröinnissä
jo esteri se muodostuu liittämällä alkoholin radikaali (R) happeen, joka jää jäljelle hapon hydroksyylistä veden muodostumisen jälkeen.
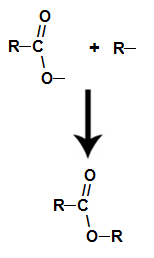
Esterimolekyylin muodostuminen
Estereiden ominaisuudet
Tärkeimmät fysikaaliset ominaisuudet esterit:
Heillä on hedelmä- ja kukka-aromeja;
matalat esterit moolimassa ne ovat nestemäisiä huoneenlämpötilassa ja ne, joilla on suuri moolimassa, ovat kiinteitä;
Estereihin verrattuna alkoholeihin ja karboksyylihappoihin estereillä on alhaisemmat sulamis- ja kiehumispisteet;
Veteen verrattuna pienemmän moolimassan esterit ovat vähemmän tiheitä;
Pienemmän moolimassan esterit ovat polaarisia ja korkeamman moolimassan ei-polaarisia;
Polaarisissa estereissä voimat ovat hallitsevia pysyvä dipoli; ei-polaarisessa asemassa vallitsevat voimat indusoitu dipoli;
Esterit, joiden moolimassa on pienempi, liukenevat huonosti veteen ja suuremmalla olevat liukenematon veteen.
Esterin nimeämissääntö
Ennen a: n nimeämissäännön käyttämistä esteri, on välttämätöntä muistaa, että tämä yhdiste muodostuu yhdistämällä kaksi osaa, joista yksi tulee karboksyylihappoa (punaisena) ja muuta alkoholia (sinisenä), kuten kuva a esittää seuraa:
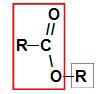
Esterin muodostavien osien tunnistaminen
Kansainvälisen puhtaan ja sovelletun kemian liiton mukaan (IUPAC), virallinen sääntö esterin nimeämiseksi on:
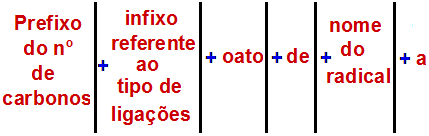
Esterin nimeämissääntö
merkintä: Etuliite ja etuliite vastaavat aina karboksyylihappo-osaa ja radikaali vastaa alkoholiosaa.
Katso alla joitain esimerkkejä estereiden nimeämissäännön soveltamisesta:
1. esimerkki: vadelma-olemus
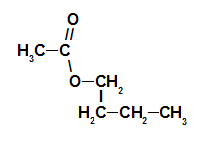
Vadelma-olemusesterin rakennekaava
Tämän esterin nimeämiseksi käytämme:
EtuliiteO hiileistä: etkoska muodostavassa hapossa on kaksi hiiltä;
Lisäys linkkien tyyppiin: ankoska muodostavalla hapolla on vain yksittäisiä sidoksia hiilen välillä;
teko;
sisään;
Radikaali: butyyli, että siinä on neljä hiiltä peräkkäin;
.
Vadelman olemusta vastaavan esterin nimi on butyylietanoaatti.
2. esimerkki: männyn kartio olemus
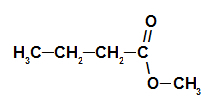
Mänty-kartioesterin rakennekaava
Tämän esterin nimen muodostamiseksi käytämme:
EtuliiteO hiileistä: muttakoska hapon muodostamisessa on neljä hiiltä;
Lisäys linkkien tyyppiin: ankoska muodostavalla hapolla on vain yksittäisiä sidoksia hiilen välillä;
teko;
sisään;
Radikaali: metyylikoska muodostavassa alkoholissa on vain yksi hiili;
.
Siten männyn kartion olemusta vastaavan esterin nimi on metyylibutanoaatti.
Kolmas esimerkki: mansikka-olemus
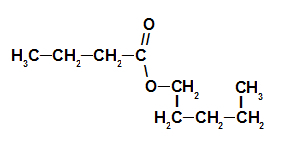
Mansikka Essence Ester Rakennekaava
Tämän esterin nimeämiseksi käytämme:
EtuliiteO hiileistä: muttakoska muodostavassa hapossa on neljä hiiltä;
Lisäys linkkien tyyppiin: ankoska muodostavalla hapolla on vain yksittäisiä sidoksia hiilen välillä;
teko;
sisään;
Radikaali: pentyylikoska muodostavassa alkoholissa on viisi hiiltä peräkkäin;
.
Mansikan olemusta vastaavan esterin nimi on pentyylibutanoaatti.
Estereiden käyttö
Esterit tunnetaan hyvin niiden käytöstä aromi jalostetuissa elintarvikkeissa eli aineissa, jotka jäljittelevät luonnollisten elintarvikkeiden, kuten hedelmien, ominaispiirteitä. Lisäksi, estereitä käytetään edelleen lääkkeiden, kosmetiikan, hajusteiden ja vahojen valmistuksessa.
Minun luona. Diogo Lopes Dias
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ester.htm

