Useimmissa autoissa käytetyt polttoaineet ovat bensiini ja etanoli. Näiden kahden polttoaineen täydellinen palaminen tuottaa hiilidioksidia (CO2 g)) ja vesi (H2O). Valitettavasti epätäydellinen palaminen ja alkoholissa ja bensiinissä olevat epäpuhtaudet voivat kuitenkin tuottaa aineita, jotka ovat erittäin saastuttavia ympäristölle. Bensiinin tapauksessa hiilimonoksidi (CO(g)); hiilivedyt (hiilestä ja vedystä koostuvat yhdisteet), kuten etaani (C2H6 g)); ja typpioksidit (NOx), pääasiassa typpimonoksidi (NO) ja typpidioksidi (NO2 g)).
Siten ilmansaasteiden lisääntymisen välttämiseksi kaikki autot tarvitsevat laitteita, joita kutsutaan katalysaattori tai katalysaattori, joka on saastumista estävä laite, jonka tehtävänä on käsitellä näitä polttomoottorin päästämiä kaasuja ja muuttaa ne vähemmän haitallisiksi kaasuiksi. Katalysaattoreita käytetään myös tähän tarkoitukseen joissakin teollisissa prosesseissa.
Mainitut epäpuhtauskaasut poistuvat moottorista ja menevät katalysaattoriin eräänlaisen "pesän" läpi, joiden solut ovat yleensä valmistettu keraamisesta tai metallisesta materiaalista, joka on päällystetty alumiinioksidilla (alumiinioksidi - Al
2O3). Tämä hunajakennomuoto pienillä kanavilla on tärkeä, koska se tarjoaa suuren kosketuspinnan kaasuille, mikä saa ne reagoimaan nopeammin.Mutta todellinen katalysaattori on metalli, joka istuu alumiinioksidin päällä. Tyypillisesti käytetyt metallit ovat palladium, rodium, platina tai molybdeeni. Voit myös sekoittaa näitä metalleja ja käyttää seoksia. Esimerkiksi bensiinin tapauksessa käytetään normaalisti palladium- ja toriumseosta; etanolin tapauksessa käytetään toista palladium- ja molybdeeniseosta. Nämä metallit suorittavat heterogeenisen katalyysin saastuttavien kaasujen kanssa.
heterogeeninen katalyysi se on eräänlainen reaktio, jossa katalyytti muodostaa reaktanttien (tässä tapauksessa saastuttavien kaasujen) kanssa monivaiheisen järjestelmän. Tämä johtuu siitä, että katalyytti adsorboituu, toisin sanoen se pitää reagoivien aineiden molekyylit pinnallaan heikentäen niiden sidoksia ja saaen reaktion etenemään nopeammin.
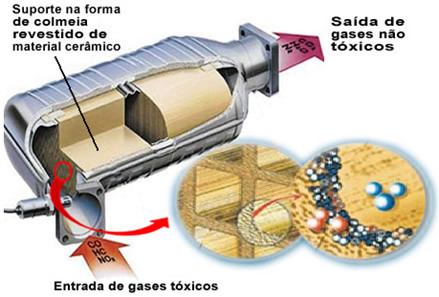
Tämän seurauksena katalyyttimetallit muuttavat saastuttavia aineita, kuten CO ja NOx myrkyttömissä kaasuissa, kuten CO2, H2O, O2 ja ei2. Katso joitain näistä reaktioista alla ja huomaa, että niiden läpi tapahtuu hiilivetyjen ja hapettumista CO (saatu epätäydellisestä palamisesta) ja myös typpioksidien pelkistys typpikaasuksi (N2):
2 CO(g) + 2 EI(g) → 2 CO2 g) + 1 N2 g)
2 CO(g) + 1 O2 g) → 2 CO2 g)
2C2H6 g) + 7 O2 g) → 4 CO2 g) + 6 H2Ov)
2 EI2 g) +4 CO(g) → 1 N2 g) + 4 CO2 g)
2 EI2 g) → 1 N2 g) + 2 O2 g)
2 EI(g) → 1 N2 g) + 1 O2 g)
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/conversor-catalitico.htm

