Kapasiteetti, joka liitäntöjen on houkuteltava sähkövarauksiin, määritellään napaisuudeksi, joka saa erilaisen luonteen riippuen liitännästä, jossa sitä esiintyy.
Yleisimmät orgaanisten yhdisteiden sidokset tapahtuvat hiiliatomien välillä tai hiili- ja vetyatomien välillä: C - C ja C - H (hiilivedyt). Tämän tyyppinen sidos luokitellaan kovalenttiseksi, sitä esiintyy kaikissa orgaanisten yhdisteiden sidoksissa, jotka muodostavat vain hiili ja vety.
Kun orgaanisen yhdisteen molekyylissä on hiilin ja vedyn lisäksi toinen kemiallinen alkuaine, sen molekyyleillä on tietty polaarisuus. Kutsumme tätä elementtiä heteroatomiksi ja se voi olla muun muassa typpi (N), happi (O).
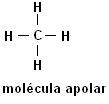
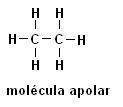
Metaani (CH4) Etaani (C2H6)
Huomaa, että molemmissa rakenteissa ei ole heteroatomeja, tässä tapauksessa molekyylit luokitellaan ei-polaarisiksi.


Hapen läsnäolo heteroatomina saa molekyylit osoittamaan polaarisuutta. Ensimmäinen molekyyli on yhdiste Etanoli (CH3CH2vai niin), hydroksyyli-OH: n läsnäolo antaa tälle yhdisteelle polaarisen merkin, vaikka rakenteessaan se sisältää ei-polaarisen osan.
Kirjoittanut Líria Alves
Valmistunut kemian alalta
Brasilian koulutiimi
Katso lisää! tasainen isomeeri
Orgaaninen kemia - Kemia - Brasilian koulu
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/moleculas-organicas-polares-apolares.htm
