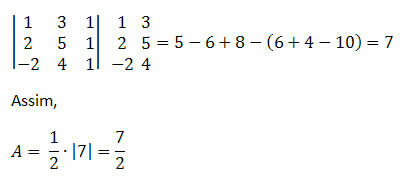Klo molekyylien väliset voimat ne ovat sähköstaattisia vetovoimia, joiden tehtävänä on yhdistää molekyylit (molekyyliyhdisteet) pitäen ne kiinteässä tai nestemäisessä tilassa. Ne ovat erittäin tärkeitä, koska ne määrittävät kaikki fyysiset ominaisuudet (sulamispiste, kiehumispiste, tiheys ja liukoisuus) aineista.
Tässä tekstissä tutkitaan molekyylien välisten voimien ja aineiden kiehumispisteen suhde. Aluksi palautetaan mieleen kolme tärkeää molekyylien välistä voimaa, jotka ovat:
♦ dipoli dipoli: on napamolekyyleissä esiintyvä voima. Koska näillä molekyyleillä on positiivinen ja negatiivinen napa, dipoli-dipolivoima perustuu vetovoimaan yhden molekyylin positiivisen pään ja toisen negatiivisen pään välillä. Esimerkkejä: HCI, HBr, SO2 ja PH3
Molekyylit, joilla on positiivinen ja negatiivinen napa, houkuttelevat toisiaan
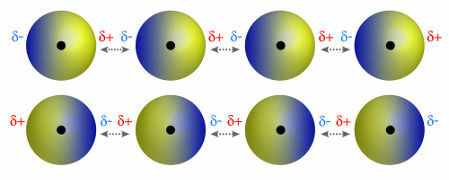
♦ Indusoitu dipoli: on molekyylien välinen voima, joka esiintyy vain ei-polaarisissa molekyyleissä (niillä ei ole napoja). Kun kaksi apolaarista molekyyliä lähestyy, niiden pilvissä tapahtuu hetkellinen muodonmuutos elektroneja, mikä aiheuttaa epätasapainoa molekyylin elektroneissa, jotka jakautuvat a erilainen hänelle. Tuolloin syntyy hetkellinen dipoli, ja molekyylillä on hetkellisesti positiivinen ja negatiivinen napa, mikä aiheuttaa vetovoiman. Esimerkkejä: CO
2, CH4 ja BH3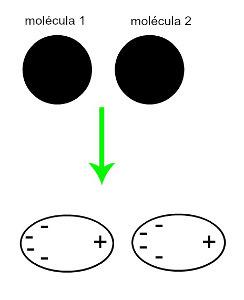
Kahden polaarisen molekyylin likiarvo luo muodonmuutoksen ja siten elektronien uudelleenjakautumisen, joka muodostaa hetkelliset dipolit
♦ Vetysidokset: molekyylien välinen voima esiintyy napamolekyyleissä, mutta vain niissä, joissa on pakollisesti vetyatomeja, jotka ovat sitoutuneet suoraan fluori-, happi- tai typpiatomeihin. Sitä voidaan pitää dipoli-dipolivoimana, mutta paljon voimakkaampana. Vuorovaikutus tapahtuu aina yhden molekyylin vedyn ja toisen molekyylin eri atomin (F, O, N) välillä. Esimerkkejä: H2O, NH3 ja HF
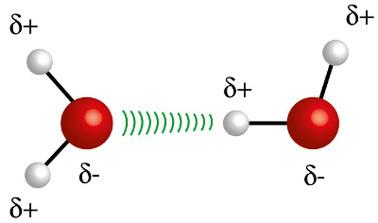
Yhden molekyylin vetyatomi (valkoinen pallo) on vuorovaikutuksessa toisen vesimolekyylin hapen (punaisen pallon) kanssa
Kun olemme muistaneet kolme molekyylien välistä voimaa, voimme nyt liittää ne aineiden kiehumispisteeseen. kutsutaan kiehumispiste lämpötila, jossa tietyn aineen molekyylit lakkaavat olemasta nestemäisessä tilassa (molekyylien väliset voimat ovat rikki) ja siirtyvät kaasumaiseen tilaan. Mielenkiintoinen yksityiskohta on, että molekyylien väliset voimat ja kiehumispiste aineilla on erittäin voimakas ja suora suhde, koska mitä voimakkaampi molekyylien välinen voima on, sitä korkeampi kiehumispiste. Molekyylien välisten voimien voimakkuuden järjestys on:
Indusoitu dipoli
Siten voimme päätellä, että molekyyleillä, joilla on vetysidoksia vuorovaikutusvoimana, on korkeammat kiehumispisteet kuin niillä, joilla on dipoli-dipoli ja niin edelleen. Seuraavassa taulukossa esitetään kolme ainetta ja niiden kiehumispistearvot:
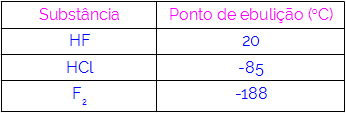
Taulukossa havaitaan, että HF: llä on korkeampi kiehumispiste, koska sen molekyylit ovat liittyneet vetysidoksilla. Aine F2 sillä on alin kiehumispiste, koska sen molekyylejä houkuttelee indusoitu dipoli.
Minun luona Diogo Lopes Dias
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/forcas-intermoleculares-ponto-ebulicao-das-substancias.htm