Kohteeseen jaksollisen järjestelmän perheet ovat taulukon pystysuorat sekvenssit ja koota kemiallisia alkuaineita joilla on samanlaiset kemialliset ominaisuudet. Tällaiset yhtäläisyydet johtuvat siitä, että samaan perheeseen ryhmitellyillä elementeillä on yhtä suuri määrä valenssielektroneja. Perheet sijoittavat edustavat elementit ryhmiin 1 ja 2, 13-18 ja siirtymäelementit ryhmiin 1-12.
Lue myös:Transuraanielementit – ihmisen valmistamat kemialliset alkuaineet, jotka tulevat uraanin jälkeen jaksollisessa taulukossa
Yhteenveto jaksollisen järjestelmän perheistä
Perheet vastaavat pystysuorat viivat Jaksollinen järjestelmä.
Perheet, jotka tunnetaan myös ryhminä, jaksollisessa taulukossa on numeroitu 1-18.
Saman perheen kemiallisilla alkuaineilla on samanlaiset kemialliset ominaisuudet.
Alkuainejoukon tuttuus selittyy sillä, että valenssielektroneja on yhtä monta.
Esittävät elementit on jaettu ryhmiin 1, 2, 13, 14, 15, 16, 17 ja 18. Jokaisella näistä perheistä on omat nimensä.
Siirtymäelementit muodostavat yhden perheen, joka on jaettu ryhmiin 3, 4, 5, 6, 7, 8, 9, 10, 11 ja 12.
Jaksojärjestelmän perheiden järjestäminen
Perheet jaksollisessa järjestelmässä ovat taulukon pystysuorat sekvenssit, eli sarakkeet. Tunnetaan myös ryhminä, jaksollisen järjestelmän perheinä on numeroitu 1-18, vasemmalta oikealle.
Samassa kolonnissa olevien kemiallisten alkuaineiden katsotaan kuuluvan samaan perheeseen., koska niiden kemialliset ominaisuudet ovat samankaltaisia, mikä johtuu siitä, että niillä on sama määrä elektroneja klo valenssikuori. Esimerkiksi kaikilla ryhmän 18 kemiallisilla alkuaineilla on kahdeksan elektronia valenssikuoressa (täyskuori) ja ne osallistuvat harvoin kemialliset sidokset.
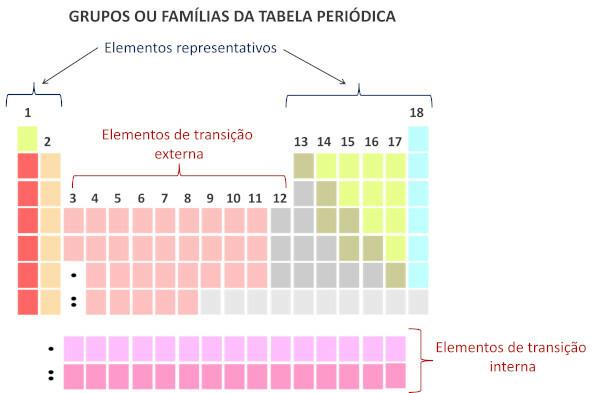
Nykyaikaisen järjestelmän mukaan Kansainvälinen puhtaan ja sovelletun kemian liitto (Iupac), jokainen ryhmä tai perhe on tunnistettu numerolla 1-18 alkaen vasemmalta oikealle jaksollisessa taulukossa.
On tärkeää korostaa, että vanha IUPAC-järjestelmä otti käyttöön aakkosnumeerisen järjestelmän, jossa kirjaimet A ja B viittaavat vastaavasti edustaviin ja siirtymäelementteihin. Tällä hetkellä tämän tyyppistä nimikkeistöä ei enää käytetä.
Jaksollisen järjestelmän perheiden nimikkeistö
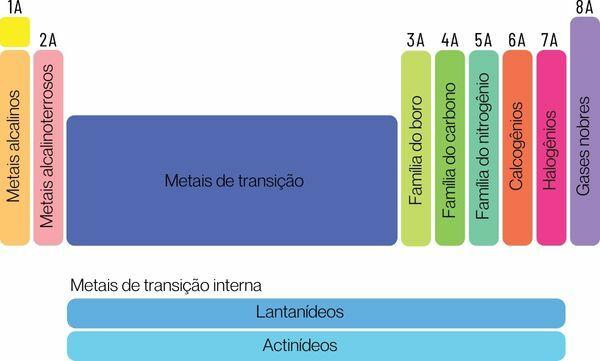
Kemialliset alkuaineet voidaan luokitella kahteen suureen perheeseen: edustavat alkuaineet ja siirtymäaineet.
→ Jaksollisen järjestelmän edustavat elementit
Esittävät elementit on jaettu ryhmiin 1, 2, 13, 14, 15, 16, 17 ja 18. Jokaisella näistä ryhmistä on oma nimi, jolla se voidaan myös tuntea. Katso:
Ryhmä 1: perhe metallit emäksinen.
Ryhmä 2: perhe maa-alkalimetallit.
Ryhmä 13: boori- tai maametalliperhe.
Ryhmä 14: hiiliperhe.
Ryhmä 15: Typpi- tai Pnicogens-perhe.
Ryhmä 16: happi- tai kalkogeeniperheeseen.
Ryhmä 17: perhe halogeenit.
Ryhmä 18: perhe jalokaasut.
→ Jaksojärjestelmän siirtymäelementit
Sinä siirtymäelementitmuodostavat yhden perheen ryhmiin 3, 4, 5, 6, 7, 8, 9, 10, 11 ja 12. Lantanidi- ja aktinidisarjat ovat myös osa siirtymäelementtejä.
Siirtymäelementit ovat kaikki metallisia ja niillä on samanlaiset kemialliset ominaisuudet, vaikka valenssikuoressa olisi erilaisia elektroneja, ja siksi ne muodostaisivat yhden ja suuren siirtymämetallien perheen.
Kemialliset alkuaineet jaksollisen järjestelmän perheistä
Jokainen perhe tai ryhmä koostuu joukosta kemiallisia alkuaineita. Katso kunkin perheen muodostavien kemiallisten alkuaineiden kuvaus:
Ryhmä 1:litium, natriumia, kaliumia, rubidium, cesium, francium.
Ryhmä 2:beryllium, magnesium, kalsiumia, strontium, barium, radio.
Ryhmä 3:skandium, yttrium, lantanidisarja ja aktinidisarja.
Ryhmä 4: titaani, zirkoniaO, hafnium se on rutherfordium.
Ryhmä 5:vanadiini, niobium, tantaali se on dubnium.
Ryhmä 6:kromi, molybdeeni, volframi se on seaborgium.
Ryhmä 7:mangaani, teknetium, renium se on bohrio.
Ryhmä 8: rauta, ruteeni, osmium se on hassium.
Ryhmä 9:koboltti, rodium, iridium ja meitnerium.
Ryhmä 10:nikkeli, palladium, platina ja darmstadtio.
Ryhmä 11: kupari, hopea, kulta ja Röntgenium.
Ryhmä 12:sinkki, kadmium, Merkurius ja Kopernikus.
Ryhmä 13: boori, alumiini, gallium, indium ja tallium.
Ryhmä 14: hiili, piitä, germanium, tina, johtaa ja flerovium.
Ryhmä 15:typpeä, loisteaine, arseeni, antimonia se on vismutti.
Ryhmä 16:happi, rikki, seleeni, telluuri, polonium ja livermorium.
Ryhmä 17: fluori, kloori, bromi, jodi ja astatiini.
Ryhmä 18:helium, neon, argon, krypton, xenon se on radon.
Tärkeä: kemiallinen alkuaine vety on erityinen tapaus, sillä vaikka se sijaitsee ryhmän 1 vieressä, se ei kuulu alkalimetalliperheeseen, koska sillä ei ole samanlaisia kemiallisia ominaisuuksia.
Tietää enemmän: Mitkä ovat jaksollisen järjestelmän radioaktiiviset alkuaineet?
Jaksollisen järjestelmän perheiden pääominaisuudet
→ Ryhmä 1 tai alkalimetallien perhe
Ne ovat metallisia kiinteitä, kiiltäviä ja sileitä.
Niillä on korkea lämmönjohtavuus ja korkea Sähkönjohtavuus.
omistaa lämpötilat suhteellisen alhainen sulamisnopeus.
Ne ovat erittäin reagoivia vettä.
Taipumus muodostaa yksiarvoisia kationeja (varaus +1).
→ Ryhmä 2 tai maa-alkalimetallien perhe
Ne ovat metallisia kiinteitä aineita, kiiltäviä ja kovempia kuin alkalimetalleja.
Ne hapettuvat helposti.
Niillä on korkea lämmönjohtavuus ja korkea sähkönjohtavuus.
Niiden sulamislämpötila on hieman korkeampi kuin alkalimetalleilla.
Ne reagoivat veden kanssa.
Taipumus muodostaa kaksiarvoisia kationeja (varaus +2).
→ Ryhmät 3-12 tai siirtymämetallien perhe
He ovat jaksollisen järjestelmän suurin perhe.
Kovia, kiiltäviä metallisia kiintoaineita.
Niillä on korkea lämmönjohtavuus ja korkea sähkönjohtavuus.
Tiheä.
Korkeat sulamislämpötilat.
voivat esittää erilaisia hapetustilat.
→ Ryhmä 13 tai booriperhe
Niillä on väliominaisuuksia metallien ominaisuuksien ja ei metalleja.
Ne ovat kiinteitä ympäristön olosuhteissa.
Taipumus muodostaa kolmiarvoisia kationeja (varaus +3).
→ Ryhmä 14 tai hiiliperhe
Niillä on väliominaisuudet metallien ja ei-metallien ominaisuuksien välillä.
Ne ovat kiinteitä ympäristön olosuhteissa.
Taipumus muodostaa neljä sidosta.
Ne ovat kiinteitä ympäristön olosuhteissa.
Hiili ja pii voivat muodostaa ketjusidoksia.
→ Ryhmä 15 tai typpiperhe
Niillä on väliominaisuudet metallien ja ei-metallien ominaisuuksien välillä.
Kiinteät aineet ympäristöolosuhteissa, lukuun ottamatta typpeä, joka on kaasu.
Typpi ja fosfori ovat olennaisia eläville organismeille.
Arseeni on erittäin myrkyllistä.
→ Ryhmä 16 tai happiperhe (kalkogeenit)
Niillä on erilaisia ominaisuuksia, jotka muuttuvat ei-metallisista metallisiksi elementeiksi, kun siirryt perheeseen.
Kiinteät aineet ympäristöolosuhteissa, lukuun ottamatta happea, joka on kaasu.
Taipumus muodostaa kaksiarvoisia anioneja (varaus -2).
→ Ryhmä 17 tai halogeenien perhe
Ne ovat ei-metalleja.
Melko reaktiivista.
Huonot lämpö- ja sähköjohtimet.
Ympäristöolosuhteissa fluori ja kloori ovat olemassa kaasut, bromi on nestemäistä ja jodi kiinteää.
Taipumus muodostaa yksiarvoisia anioneja (varaus -1).
→ Ryhmä 18 tai jalokaasuperhe
Ne ovat ei-metalleja.
Hyvin vähän reaktiivisia, joten niitä voidaan kutsua inertteiksi kaasuiksi.
Ne esiintyvät kaasujen muodossa.
Niillä ei ole taipumusta muodostua ioneja.
Jaksotaulu ja sähköinen jakelu
Samaan perheeseen tai ryhmään kuuluvilla kemiallisilla alkuaineilla on samanlaiset kemialliset ominaisuudet, koska niillä on yhtä suuri määrä elektroneja valenssikuoressa.
Valenssikuoressa olevien elektronien määrällä on merkitystä, sillä se määrää kationien tai kationien muodostustaipyyden. anionit, muodostuvan kemiallisen sidoksen tyyppi, kemiallisiin reaktioihin osallistuva energia, mm ominaisuudet. Valenssielektronien lukumäärän selvittämiseksi, on välttämätöntä tietää atominumero elementistä ja suorita omasi sähköinen jakelu.
→ Edustavien elementtien sähköinen jakelu
Edustavia elementtejä niillä on energisimmat elektroninsa alatasoilla s se on P elektronisen kerroksen (n). Seuraavassa taulukossa on koottu kuhunkin edustavien elementtien perheeseen liittyvät elektroniset konfiguraatiot. termi n vaihtelee välillä 1-7 ja edustaa valenssielektronien käyttämää energiatasoa, joka vastaa jaksollisen järjestelmän jaksoa (vaakaviivaa), jossa elementti löytyy.
Edustavien elementtien sähköinen jakelu | ||
perhe tai ryhmä |
Sähköinen jakelu |
Esimerkki |
1 |
meille1 |
Li (Z = 3): 1 s2 2s1 |
2 |
meille2 |
Ole (Z=4): 1 s2 2s2 |
13 |
meille2 np1 |
B (Z=5): 1 s2 2s22p1 |
14 |
meille2 np2 |
C (Z=6): 1 s2 2s22p2 |
15 |
meille2 np3 |
N (Z = 7): 1 s2 2s22p3 |
16 |
meille2 np4 |
O (Z = 8): 1 s2 2s22p4 |
17 |
meille2 np5 |
F (Z=9): 1 s2 2s22p5 |
18 |
meille2 np6 |
Ne (Z = 10): 1 s2 2s22p6 |
→ Siirtymäelementtien sähköinen jakelu
Siirtymäelementit on jaettu ryhmiin 3 ja 12 ja on alatasot d se on f valenssielektronien miehittämä:
Ulkoiset siirtymäelementit: pitää valenssielektronit alitasolla d, pitäen elektronikonfiguraation yhtä suurena kuin meille2 (n-1)d(1-8). Esimerkiksi alkuaine nikkeli (Z = 28) kuuluu ryhmään 10 ja sen konfiguraatio on 1s2 2s2 2p6 3s2 3p6 4s2 3d8.
Sisäiset siirtymäelementit: ne ovat osa ryhmää 3, mutta ovat jaksollisen järjestelmän "sisäisiä" laajennettuna sen alapuolelle jaksoissa 6 (lantanidit) ja 7 (aktinidit). Näillä elementeillä on valenssielektroneja, jotka miehittävät alakuoren f ja yleinen elektroninen konfigurointi meille2 (n-2)f(1-13). Esimerkiksi alkuaine lantaani (Z = 57) on ensimmäinen alkuaine lantanidisarjassa ja sen elektronikonfiguraatio on 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f1.
Tiedä myös:Mikä on jaksollisen järjestelmän alkuperä?
Ratkaistiin harjoituksia jaksollisen järjestelmän perheistä
Kysymys 1
(UFC – mukautettu) Mitä tulee nykyaikaiseen jaksolliseen elementtien luokitukseen, rastita oikea väite:
A) Perheet tai ryhmät jaksollisessa taulukossa vastaavat vaakasuuntaisia viivoja.
B) Perheen elementeillä on hyvin erilaisia kemiallisia ominaisuuksia.
C) Perheessä alkuaineilla on yleensä sama määrä elektroneja viimeisessä kuoressa.
D) Aikana alkuaineilla on samanlaiset kemialliset ominaisuudet.
E) Edustavat elementit on jaettu ryhmiin 3-12.
Resoluutio:
Vaihtoehto C
Kohta A on virheellinen: perheet tai ryhmät ovat jaksollisen järjestelmän sarakkeita (pystysuorat rivit).
Kohta B ja D väärin: Perheessä elementeillä on samanlaiset kemialliset ominaisuudet. Jaksoissa elementeillä on sama elektronikuori, joka on valenssielektronien käytössä.
Kohta C oikein: Perheessä alkuaineilla on sama määrä elektroneja viimeisessä kuoressa.
Kohta E virheellinen: edustavia elementtejä ovat ryhmät 1, 2, 13, 14, 15, 16, 17 ja 18. Siirtymäelementit on jaettu ryhmiin 3-12.
kysymys 2
(EAM) Elementeillä A, B ja C on seuraavat elektronikonfiguraatiot valenssikuorissaan:
V: 3s1
B: 4s2 4p4
C: 3s2
Valitse oikea vaihtoehto näiden tietojen perusteella.
A) Alkuaine A on alkalimetalli.
B) Alkuaine B on halogeeni.
C) Alkuaine C on kalkogeeni.
D) Elementit A ja B kuuluvat jaksollisen järjestelmän kolmanteen jaksoon.
E) Kolme elementtiä kuuluvat samaan jaksollisen järjestelmän ryhmään.
Resoluutio:
Vaihtoehto A
Kohta A oikein: elementillä A on elektroninen jakauma, joka sisältää vain yhden valenssielektronin, joten se kuuluu jaksollisen järjestelmän ryhmään 1.
Väärä kohde B: elementillä B on 4s elektronikonfiguraatio2 4p4, mikä osoittaa, että viimeisessä kuoressa on 6 elektronia ja että tämä alkuaine kuuluu ryhmään 16 (kalkogeenit).
Väärä kohta C: elementillä C on elektroninen konfiguraatio, jossa on 2 elektronia viimeisessä kuoressa, joten se on taulukon ryhmän 2 elementti.
Väärä kohde D: elementti A kuuluu kolmanteen jaksoon (n = 3) ja elementti B kuuluu neljänteen jaksoon (n = 4).
Väärä kohta E: kolmella elementillä on eri määrä elektroneja viimeisessä kuoressa, joten ne eivät voi kuulua samaan perheeseen.
Kirjailija: Ana Luiza Lorenzen Lima
Kemian opettaja
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/familias-da-tabela-periodica.htm

