osmoskopia On yhteisomistus (muut ovat tonoskopia, ebullioskopia ja kryoskopia), joka tutkii osmoosi kahden eripitoisen liuoksen välillä, joista toinen on väkevämpi kuin toinen.
Huomautus: Kolligatiivisia ominaisuuksia esiintyy, kun haihtumaton liuoteaine lisätään liuottimeen.
Kuten osmoskopia tutkia osmoosia, on välttämätöntä tietää Mikä on Tämä ilmiö. Tätä varten käytämme alla olevia ratkaisuja, jotka on erotettu puoliläpäisevällä kalvolla:
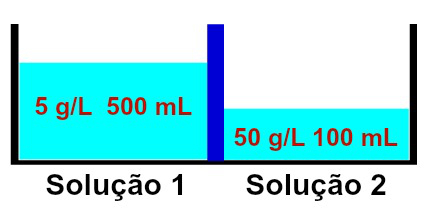
Esitys ratkaisuista, joilla on erilaiset pitoisuudet
Havaitaan, että liuos 1 sisältää konsentraation 5 g / l ja tilavuuden 500 ml, kun taas liuoksen 2 pitoisuus on 50 g / l ja tilavuus 100 ml, erotettuna kalvolla puoliläpäisevä. Liuos 2 on väkevämpi kuin liuos 1, ja siksi niiden välillä on oltava osmoosia.
Osmoosin täytyy välttämättä tapahtua liuoksesta 1 liuokseen 2, koska liuos 1 on vähemmän väkevöity. Tämän tapahtuman aikana osa liuottimesta ylittää puoliläpäisevän membraanin, jolloin liuoksen tilavuus on 2 kasvaa ja liuoksen 1 tilavuus pienenee, kunnes molemmilla liuoksilla alkaa olla sama pitoisuus, ts. isotonia.

Liuosten 1 ja 2 korkeuden muutos osmoosin vuoksi
Huomaa: Isotoniset väliaineet ovat niitä, joiden pitoisuus on sama.
Mukaan osmoskopia, osmoosi tapahtuu, koska liuottimen suurin höyrynpaine vähemmän väkevässä liuoksessa on suurempi kuin väkevämmässä liuoksessa olevan liuottimen höyrynpaine. Nyt, jos haluamme estää osmoosin esiintymisen, paina vain väkevintä liuosta:
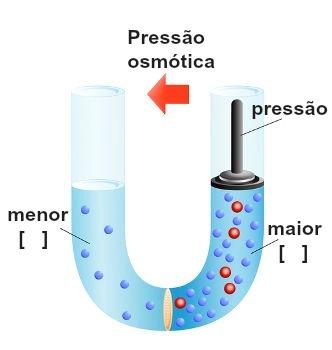
Esitys paineen toteutumisesta väkevimmälle liuokselle
Tätä painetta, joka kohdistuu väkevyimpään liuokseen estämään tai jopa käänteisosmoosin, kutsutaan osmoottinen paine ja sitä edustaa symboli π. Sen tulisi olla suoraan verrannollinen liuoksen konsentraatioon.
Mahdolliset osmoottisen paineen tulkinnat
.EU: n päätelmien mukaan osmoskopia, jokaisella liuoksella on osmoottinen paine, koska se liittyy konsentraatioon, joka on jokaisessa liuoksessa oleva ominaisuus.
Vertaamalla yhtä väliainetta tai ratkaisua toiseen voimme käyttää seuraavia termejä:
Hypertoninen: kun yhden väliaineen osmoottinen paine on suurempi kuin toinen;
hypotoninen: kun yhden väliaineen osmoottinen paine on pienempi kuin toisen;
Isotoninen: kun kahdella väliaineella tai liuoksella on sama osmoottinen paine.
Siten verrattaessa kahden ratkaisun A ja B osmoottisia paineita, joita edustaa πTHE ja πB, voimme sanoa, että:
Jos A: n ja B: n osmoottinen paine ovat samat, välineet tai ratkaisut ovat isotonisia:
πTHE = πB
Jos A: n osmoottinen paine on suurempi kuin B: n osmoottinen paine, väliaine A on hypertoninen suhteessa B: hen:
πTHE> πB
Jos B: n osmoottinen paine on pienempi kuin A: n osmoottinen paine, väliaine B on hypotoninen suhteessa B: hen:
πB< πTHE
Kaava osmoottisen paineen laskemiseksi
π = M.R.T.
Tässä kaavassa:
π = on osmoottinen paine
M = on pitoisuus mol / l
R = on yleinen kaasuvakio (0,082 paineelle atm; 62,3 paineessa mmHg)
T = lämpötila kelvineinä
Koska pitoisuudella mol / l on erityinen kaava, kuten alla on esitetty:
M = m1
M1.V
Voimme korvata sen osmoottisen paineen kaavassa:
π = m1.R.T
M1.V
Huomaa: Jos liuoksessa oleva liuoteaine on ioninen, meidän on käytettävä Van't Hoff -korjauskerroin i) osmoottisen paineen laskennassa:
π = M.R.T.i
Esimerkki osmoottisen paineen laskemisesta
Esimerkki: (UF-PA) Liuos, joka sisältää 2 mg uutta antibioottia 10 ml: ssa vettä 25 ° C: ssa, tuottaa osmoottisen paineen 0,298 mmHg. Joten tämän antibiootin molekyylipaino on suunnilleen:
a) 3000
b) 5200
c) 7500
d) 12500
e) 15300
Harjoituksen toimittamat tiedot olivat:
π = 0,298 mmHg
T = 25 OC tai 298 K (lisäämällä 273: een)
m1 = 2 mg tai 0,002 g (jaettuna 1000: lla)
V = 10 ml tai 0,01 L (jaettuna 1000: lla)
R = 62,3 mmHg
Voit ratkaista tämän harjoituksen yksinkertaisesti soveltamalla käytettävissä olevaa tietoa lausekkeeseen osmoottisen paineen laskemiseksi seuraavasti:
π = m1.R.T
M1.V
0,298 = 0,002.62,3.298
M1.0,01
0,298M1.0,01 = 37,1308
0,00298M1 = 37,1308
M1 = 37,1308
0,00298
M1 = 12460 u
Minun luona. Diogo Lopes Dias
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-osmoscopia.htm

