THE pastaatomi, Kuten nimestä voi päätellä, se on atomin massa, jota yleensä symboloi "mThe" tai "MA". Koska atomi on kuitenkin erittäin pieni, ihmissilmälle näkymätön kokonaisuus, sen massaa ei ole mahdollista mitata esimerkiksi asteikoilla. Joten tiedemiehet määrittelivät atomien massan vertaamalla niitä muiden atomien massaan.
Tämä tehdään myös muiden yksiköiden kanssa. Esimerkiksi massayksikkö on standardikilo, joka vastaa sylinteriä, jonka korkeus ja halkaisija on 3,917 cm ja joka on valmistettu 10 % iridiumista ja 90 % platinasta. Joten se toimii vertailuna. Esimerkiksi, jos "punnitamme" esineen vaa'alla ja huomaamme, että sen massa on 10 kg, se tarkoittaa, että sen massa on 10 kertaa suurempi kuin valittu standardi: 1 kg.
Älä lopeta nyt... Mainonnan jälkeen on muutakin ;)
Sama koskee atomeja. Standardiksi valittiin hiili-12, ja tämän atomin massaksi määritettiin mielivaltaisesti 12 u. "u" on atomimassan yksikkö ja vastaa siten 1/12 hiiliatomin massasta.
Esimerkiksi kun sanomme, että vedyn atomimassa on 1 u, se tarkoittaa, että se on ikään kuin jos jaamme hiilen 12 osaan, yhden näistä osista massa vastaa atomin massaa vety. Toinen esimerkki on rikki, jonka atomimassa on 32 u, mikä tarkoittaa, että sen massa on 32 kertaa suurempi kuin 1/12 massasta
12Ç.1 u = 1/12 1 hiiliatomin massasta 12

Atomimassayksikkö on 1/12 hiili-12:n massasta
Aineiden molekyylimassa on alkuaineiden atomimassojen summa. Esimerkiksi hapen atomimassa on 16 u, joten happikaasumolekyylin molekyylimassa (O2) on yhtä suuri kuin 32u.
Koska laboratoriotekniikat ovat tällä hetkellä erittäin kehittyneitä, on olemassa laitteita, jotka mittaavat tarkasti alkuaineiden atomimassan, kuten massaspektrometri. Näin ollen se on mahdollista tietää 1 u on yhtä suuri kuin 1,66054. 10-24 g.
Mielikartta: Atomimassa

*Lataaksesi ajatuskartan PDF-muodossa, Klikkaa tästä!
Koska atomimassat määritetään erittäin tarkasti, ne esitetään jaksollisessa taulukossa desimaalilukuina. Mutta kun lähdemme tekemään laskelmia, käytämme yleensä pyöristettyä lukua, lukuun ottamatta kokeita, joiden on oltava erittäin tarkkoja. Jos esimerkiksi katsot jaksollista taulukkoa, näet, että hapen atomimassa on 15 999 u, mutta yleensä käytämme laskelmissa arvoa 16 u. Tämä tapahtuu myös hiilen kanssa, jonka atomimassa on 12,01 u, kuten alla on esitetty:
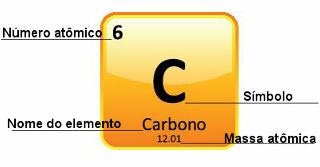
Hiilen esitys jaksollisessa taulukossa
Jaksottaisessa taulukossa näkyvät alkuaineet ovat itse asiassa kaikkien alkuaineen luonnollisten isotooppien painotettuja keskiarvoja. Siten taulukossa näkyvä atomimassa on myös näiden alkuaineiden atomimassojen keskiarvo. Esimerkiksi kloorilla (C2) on kaksi luonnollista isotooppia, 35 ja 37, joiden vastaavat prosenttiosuudet luonnossa ovat 75,76 % ja 24,24 %. Jokaisen näiden isotoopin atomimassat ovat erilaiset, jolloin Cp-35:n atomimassa on 34,96885 u ja Cp-37:n atomimassa on 36,96590.
Tällä tavalla alkuaineen atomimassa lasketaan ottaen huomioon kunkin isotoopin massa ja runsaus, jolla se esiintyy luonnossa. Kloorin tapauksessa meillä on:
Alkuaineen atomimassa kloori = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
Alkuaineen kloori atomimassa = 35,45
Tämä on kloorin atomimassaarvo, joka näkyy jaksollisessa taulukossa.
* Minun Diogo Lopesin ajatuskartta
Kirjailija: Jennifer Fogaça
Valmistunut kirjaimista