Polymerointi on kemiallisen prosessin nimi, joka johtaa makromolekyylien (suurien molekyylien) muodostumiseen, joita kutsutaan polymeereiksi, yhdistämällä pienempiä molekyylejä, monomeereja.
reaktio polymerointi se on hyvin yleinen luonnossa, kuten voimme nähdä hiilihydraateissa (kuten tärkkelys) ja proteiineissa (kuten maidossa oleva kaseiini). Sitä esiintyy myös synteettisesti, koska suurin osa ihmisten jokapäiväisessä elämässään käyttämistä polymeereistä on valmistettu keinotekoisesti.
Ensimmäinen polymeeri, joka on valmistettu polymerointi synteettinen oli belgialaisen kemistin Leo Hendrik Baekelandin vuonna 1909 kirjoittama bakeliitti.
Yleensä monomeeri yhdistetään toisen kanssa (ovatpa ne samoja tai erilaisia) reaktiossa polymerointiOn välttämätöntä, että molemmissa monomeereissä on vapaa valenssi (suoritettava kemiallinen sidos).
Nämä valenssit syntyvät sidosten katkeamisen seurauksena, kun käytetään katalyyttejä (kuten nikkeliä), ulkoiset olosuhteet, kuten valo ja lämpö, tai rakenteen resonanssiilmiö (elektronien siirtymä).
Esimerkiksi kotitalousvälineissä ja leluissa käytettävän polypropeenin (PP-polymeerin) muodostuksessa pi linkki (π) jokaisessa molekyylissä jakautuu seuraavasti:
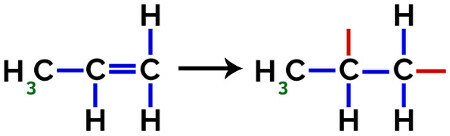
Pi-sidoksen katkeaminen propeenissa
Siten jokainen propeenimonomeeri voi sitoutua kahden muun propeenimonomeerin kanssa ja muodostaa polymeerin PP tai polypropeenin (etuliite poly osoittaa useita monomeeriyksiköitä). Yleisin tapa esittää polymeeriä on monomeeri sulkeissa ja sen ulkopuolella kirjain n, joka osoittaa useita monomeerejä, kuten voimme nähdä PP-polymeerin tapauksessa:
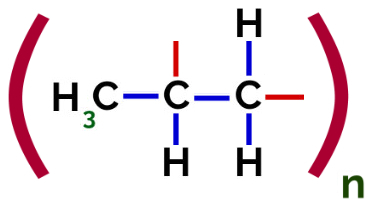
PP-polymeerin esitys
reaktio polymerointi voidaan tehdä eri tavoilla, kuten alla nähdään:
a) Reaktio additiopolymerointi
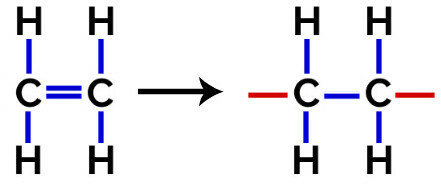
Tässä polymerointi, monomeerissä tapahtuu aina pi-sidoksen katkeaminen, mikä aiheuttaa kahden vapaan valenssin muodostumisen rakenteeseen, kuten polyeteeni, polymeeri, jota käytetään laajasti lääkepakkauksissa.
Polyeteenin lisäyspolymeerin rakennekaava
klo polymerointi Polyeteenistä monomeerinä käytetään eteenin (eteenin) molekyylejä, joissa on pi-sidos kahden hiiliatomin välillä. Kun tämä sidos katkeaa, ilmaantuu kaksi vapaata valenssia, yksi jokaisessa pii-sidoksessa mukana olleessa hiiliatomissa. Monomeerit yhdistyvät täsmälleen kussakin näistä valenssista, eli yhden valenssi on kytketty toisen valenssiin ja niin edelleen.
Polyeteenin muodostumisyhtälö
b) Lisäyspolymerointireaktio 1.4
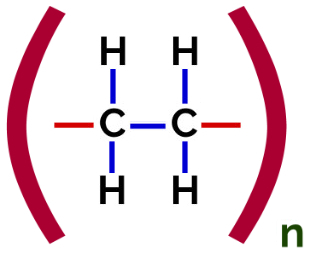
Tässä polymeroinnissa monomeerit muodostavat kaksi vuorotellen kaksoissidosta (yksi pi ja yksi sigma), mikä suosii ilmiötä. resonanssi (pi-sidoksen pi-elektronien paikan vaihtelu), kuten synteettisen kumin (polybutadieeni) muodostumisessa

Polybutadieenin rakennekaava
Tämän polymeerin monomeerinen yksikkö on butadieeni, jossa on kaksi vuorotellen kaksoissidosta. Resonanssilla rakenteessa on kaksoissidos hiilen 2 ja 3 välillä ja kaksi vapaata valenssia hiileissä 1 ja 4. Juuri näissä hiilen 1 ja 4 vapaissa valensseissa monomeerit yhdistyvät.

Butadieeniresonanssi
c) Reaktio kondensaatiopolymerointi tai eliminointia
Se on reaktio polymerointi jossa pakollisesti kaksi monomeeriä (sama tai eri) menettää samanaikaisesti atomeja tai ryhmiä, jolloin kummassakin on kaksi vapaata valenssia. Tällä tavalla monomeerista poistuu aina vety, joka sitten liittyy halogeeniin (F, Cl, Br, I), OH: iin, NH: iin.2tai toisen monomeerin CN: ään.
Joten sisällä polymerointi eliminoimalla muodostuu aina vettä, halogenoitua happoa (HCl, HI, HF, HBr), ammoniakkia (NH3) tai syaanivetyhappoa (HCN) polymeerin lisäksi. Katso esimerkiksi esitys polyesterin muodostumisesta, kankaana käytetystä materiaalista:

Polyesterin muodostumisyhtälö
Polyesteriä muodostavia monomeerejä ovat p-bentseenidihappo ja etaani-1,2-dioli. Voimme huomata sen tässä polymerointi vesimolekyylien eliminaatio tapahtuu, koska kahdella monomeerillä on kaksi hydroksyyliä. Tässä prosessissa happo menettää kaksi hydroksyyliä ja dialkoholi vain vedyn hydroksyyleistään:

Polyesterirakenne
Polyesterimonomeerit liittyvät yhteen alkoholin hapen ja karboksyylihapon hiilen avulla.
Kirjailija: Me. Diogo Lopes Dias
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-polimerizacao.htm

