Sinä emäksiset oksidit ne ovat sellaisia, jotka reagoiessaan veden kanssa muodostavat emäksiä. Kun ne reagoivat hapon kanssa, ne muodostavat suolaa ja vettä.
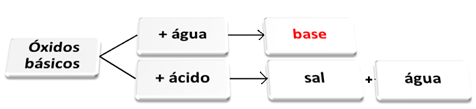
Emäksiset oksidit, jotka reagoivat veden ja hapon kanssa.
Meillä on esimerkiksi natriumoksidia (Na2O), joka on emäksinen oksidi. Katso alla, että reagoidessaan veden kanssa se muodostaa natriumhydroksidiemäksen:
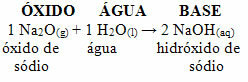
Jos sama oksidi reagoi hapon, kuten rikkihapon (H2VAIN4), muodostuu suolaa (natriumsulfaattia) ja vettä.
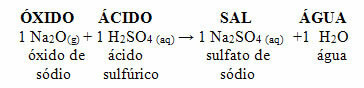
Jos emäksinen oksidi reagoi happaman oksidin kanssa, syntyy myös suolaa, mutta ilman vettä.
Kuten esimerkissä näkyy, muutkin emäksiset oksidit ovat ioniyhdisteitä, jotka muodostuvat niissä enimmäkseen metalleista, elementeistä, jotka ovat erittäin sähköpositiivisia ja jotka tavallisesti esittävät "varauksen", joka on yhtä suuri kuin +1 tai +2.
Esimerkkejä:
klo2O = Na1+
K2O = K1+
CaO = Ca2+
MgO = Mg2+
Näillä yhdisteillä on korkeat sulamis- ja kiehumispisteet ja kaikki sisältävät happianionin (O2-).
Joidenkin perusoksidien sovellukset:
• Koira: Kalsiumoksidi
Tämä yhdiste tunnetaan yleisesti nimellä poltettu kalkki. Kun reagoidaan veden kanssa alla olevan reaktion mukaisesti, muodostuu emäs (kalsiumhydroksidi), jota käytetään seinien maalaamiseen, puunrungot ja muut materiaalit, joiden pääasiallinen tarkoitus on karkottaa hyönteisiä, säilyttää tiiviste ja estää tunkeutuminen vedestä. Tätä muodostunutta pohjaa kutsutaan sammutettua kalkkia ja siksi, kun maalaat sillä, annat sille nimen whitewash maali.
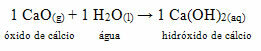

Whitewash maalaus.
• K2O: kaliumoksidi
Kaliumoksidia löytyy yleisesti puusta ja savukkeiden tuhkasta. Reagoiessaan veden kanssa se muodostaa emäksisen kaliumhydroksidin (KOH), jota käytetään saippuoiden valmistuksessa. Jo aiemmin paikoissa, joissa ei ollut KOH: ta, käytettiin kasvituhkaa, joka sisälsi K2O, reagoida rasvojen kanssa ja tuottaa ns "harmaa saippua".
Kirjailija: Jennifer Fogaça
Valmistunut kemiasta
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/oxidos-basicos.htm

