Aineiden molekyylit eivät ole kaikki suoria, ikään kuin ne olisivat yhdessä tasossa. Loppujen lopuksi ne ovat hajallaan avaruudessa ja niiden atomit ottavat erilaisia järjestelyjä tai järjestelyjä. Siten kunkin ainetyypin molekyyleillä on erilaisia geometrisia muotoja.
Yksi yksinkertaisimmista tavoista määrittää molekyylin geometria perustuu teoriaan valenssikuorielektroniparien hylkiminen (RPECV). Tämän teorian mukaan keskusatomin elektroniparit toimivat seuraavasti elektroniset pilvet jotka hylkivät toisiaan. Tällä tavalla ne suunnataan mahdollisimman kauas toisistaan. Molekyyligeometria riippuu keskusatomin ympärillä olevien elektroniparien lukumäärästä.
Tämä elektroninen pilvi voi koostua elektroneista, jotka osallistuvat sidoksiin (yksi-, kaksois- tai kolminkertainen) ja myös niistä, jotka eivät osallistu. Meillä on siis:
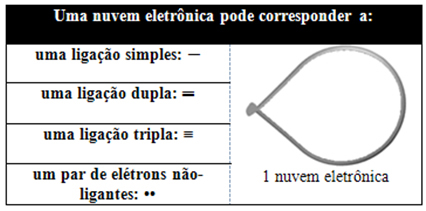
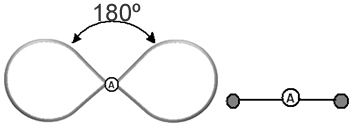
Auttaa ajattelemaan tätä pilvtä kytkettynä ilmapallona tai ilmapalloina, joiden keskiatomi on niiden keskellä. Esimerkiksi molekyylissä, jossa on vain kaksi elektronipilveä keskusatomin ympärillä, sitä suurempi mahdollinen etäisyys niiden välillä on 180º kulma ja siten molekyylin geometria on lineaarinen.
Siksi voimme tehdä päätelmän siitä, millainen useimpien molekyylien molekyyligeometria on, jos otamme huomioon atomien lukumäärä molekyyleissä ja sidokset, jotka keskusatomi muodostaa, tarkistaen, onko siinä pareja vai ei elektroneja.
Katso alla olevat esimerkit:
- Molekyylit, joissa on 2 atomia: tulevat aina olemaan lineaarinen
Esimerkiksi:
H─H, H─Cl, F─F, O═O, C≡O.
- 3-atominen molekyyli: kulmikas tai kolmiomainen
jos keskusatomi omaa parin ei-sitovia elektroneja geometria tulee olemaan kulmikas, kuten SO-molekyylin tapauksessa2:
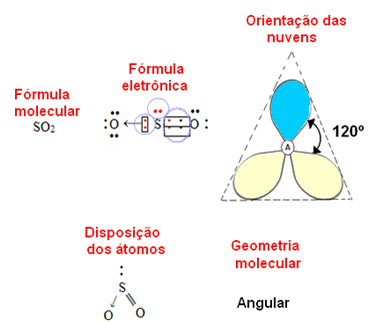
Ajatellaan, että sininen elektronipilvi edustaa elektronipareja, jotka eivät osallistu sidoksiin, ja keltaisen elektronipareja, jotka osallistuvat sidoksiin.
- 4-atomin molekyyli: taso trigonaalinen (tai kolmiomainen) tai pyramidimainen (tai trigonaalinen pyramidi)
Jos keskusatomissa ei ole parittomia (sidostumattomia) elektronipareja, molekyyligeometria on tasainen trigonaalinen (tai kolmiomainen). Katso esimerkkiä BF3:

Jos atomissa on ei-sitovia elektronipareja, molekyylin geometria on pyramidimainen (tai trigonaalinen pyramidi), kuten ammoniakin tapauksessa:

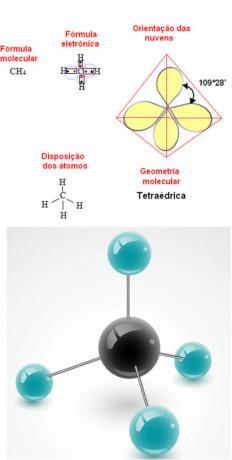
- 5-atomin molekyyli: tetraedrinen
Esimerkki metaanigeometriasta:
- Molekyyli, jossa on 6 atomia: trigonaalinen bipyramidi tai kolmiopyramidi.
Esimerkki on fosforipentakloridi (PCl5), jolla on jotkin fosforin ja kloorin väliset yhteydet 90 asteen kulmassa ja toiset 120 asteen kulmassa muodostaen bipyramidin, jossa on kolmion muotoinen pohja:
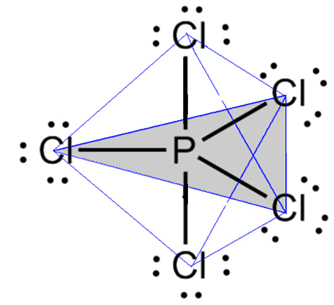
- 7-atomin molekyyli: oktaedri
Esimerkki: rikkiheksafluoridi (SF6), jonka kulmat ovat 90º.

Kirjailija: Jennifer Fogaça
Valmistunut kemiasta
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/determinacao-geometria-das-moleculas.htm
