Voit ymmärtää ilmiön ionisaatio ensin on tarpeen tietää, mitkä ionit ovat. Ota huomioon seuraava selitys:
Jokaisella atomilla on sama määrä protoneja ja elektroneja; siksi jokainen atomi on sähköisesti neutraali. Lisäksi atomiryhmien muodostamissa aineissa on myös sähkövaraustasapaino, joka on sähköisesti neutraali.
kuitenkin, atomi tai atomiryhmä voi menettää tai saada elektroneja; kun näin tapahtuu, he menettävät puolueettomuuden ja niistä tulee ioneja.
Jos atomi tai atomiryhmä menettää elektroneja, se on positiivisesti varautunut ja se on nimeltään ioni kationia. Jos kuitenkin saat elektronia, varaus on negatiivinen ja ioni on a anioni.
Epäorgaaniset aineet ovat ionisia tai niillä on kyky muodostaa ioneja.
Yksi tapa muodostaa ioneja on sijoittaa molekyyliaineita veteen, toisin sanoen kovalenttisilla sidoksilla muodostettuihin elektroneihin.
Esimerkiksi, jos testataan kloorivetyhapon (HCl) sähköinen johtuminen vesiliuoksessa (kloorivety veteen liuotettuna), näemme, että liuos on elektrolyyttinen, ts. se johtaa sähkövirtaa, koska tässä on ioneja ratkaisu.

Tämä tarkoittaa, että vesi toimi reagenssina muodostaen suolahaposta ioneja. Tämä tapahtuu alla olevan reaktion mukaisesti:
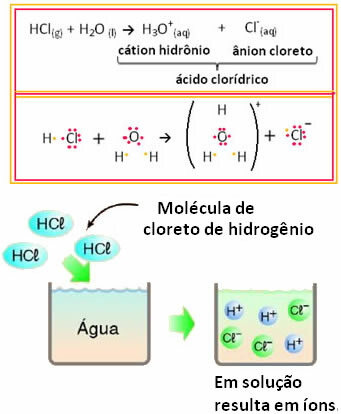
Huomaa, että ennen kloorivetyä veteen ei ollut ioneja. Sen molekyylit reagoivat kuitenkin veden kanssa ja muodostivat positiivisia H-ioneja3O+ (kationit) ja negatiiviset Cl- (anionit). Koska kloori on elektronegatiivisempi kuin vety, se houkuttelee elektroniparin lähellä olevasta kovalenttisesta sidoksesta ja muodostaa anionin. Vetyä puolestaan houkuttelee vedessä oleva happi, joka on enemmän elektronegatiivista kuin kloori; ja vedyn ja hapen välille muodostuu kovalenttinen sidos, mikä saa aikaan hydrroniumkationin. Tätä ionien muodostumisen ilmiötä kutsutaanionisaatio.
Yllä olevan selityksen perusteella voimme määritellä ionisaation seuraavasti:

Huomaa, että ioneja ei ollut aiemmin, koska jos niitä olisi, kuten ioniyhdisteiden liukenemisessa, meillä olisi ioninen dissosiaatio eikä ionisaatio.
Kaikki veden kanssa kosketuksiin joutuvat hapot ionisoituvat. Kaikille molekyyliyhdisteille ei kuitenkaan suoriteta ionisaatiota.Esimerkiksi sokeri (C12H22O11) on molekyyli, mutta veteen laitettuna ioneja ei muodostu, vaan se vain liukenee, mikä johtaa ei-elektrolyyttiseen molekyyliliuokseen, joka ei johda sähköä.
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
