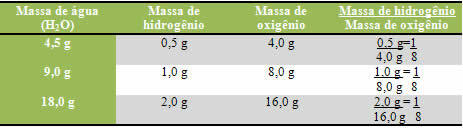
Suodatus on menetelmä heterogeenisten kiinteiden nesteiden ja kaasujen ja kiinteiden seosten erottamiseksi.
Se on yleisin menetelmä liukenemattoman kiinteän aineen erottamiseksi nesteestä.
Jokapäiväisessä elämässä suodatusta käytetään usein kiinteiden hiukkasten poistamiseen esimerkiksi vedenpuhdistamoissa ja kahvinvalmistuksessa.
Tyypit
Suodatusta on kahta tyyppiä: yksinkertainen ja tyhjiö.
Yksinkertainen tai yleinen suodatus
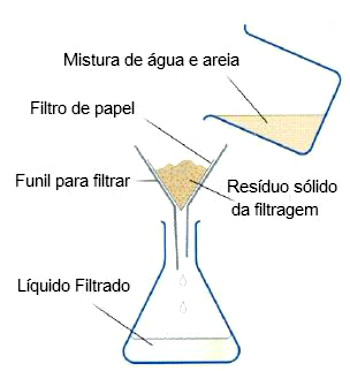
Yllä olevassa esimerkissä havainnollistettu yksinkertainen suodatus tehdään asentamalla este, joka voi olla paperia tai suodatinverkkoa suppiloon.
Suppilo asetetaan astian sisääntuloon ja siihen kaadetaan vesi- ja hiekkasekoitus.
Täten kiinteät hiukkaset, joita kutsutaan jätteiksi, pysähtyvät esteessä ja erotetaan suodatetusta materiaalista.
Tyhjiösuodatus
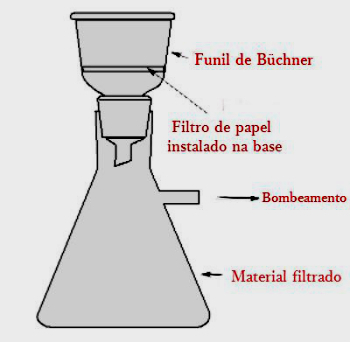
Tyhjiösuodatusta tai alennettua painesuodatusta käytetään nopeuttamaan erotusprosessia, ja se koostuu suodattimen alla olevan ilman harvinaisuudesta.
Prosessi suoritetaan Buchner-suppilon sisällä, posliiniväline porattu pohjaan.
Buchner-suppilo asetetaan sarjaan, joka vastaanottaa suodatettavan nesteen.
Tätä tekniikkaa käytetään kiinteän tuotteen erottamiseen liuotinseoksesta kemiallisen reaktion avulla.
Tässä prosessissa nesteen ja kiinteän aineen seos kaadetaan paperin läpi Buchner-suppiloon.
Kiintoaine jää suodattimen luo ja neste poistetaan suppilon kautta pulloon tyhjössä.
Muut menetelmät seosten erottamiseksi
Muita menetelmiä heterogeenisten seosten erottamiseksi ovat:
- dekantti
- hoito
- vaahdotus
- murtolukko
- magneettierotus.
Homogeenisten seosten erottamiseksi käytetyt menetelmät ovat yksinkertainen tai jakotislaus ja kiteytys.
Tarkista pääsykokeen kysymykset ja kommentoitu palaute:erotuksen sekoittamisen harjoitukset.