Kokeilut ovat käytännöllinen tapa oppia ja testata tietosi kemiassa opiskelluista käsitteistä.
Hyödynnä näitä kemiallisia kokeita, jotka voidaan tehdä kotona (aikuisten valvonnassa) tai työskennellä luokkahuoneessa opettajan kanssa täydentämään opintojasi.
Ensimmäinen kokemus - värien purkaminen
Käsitteet: kromatografia ja seosten erottaminen
Materiaalit
- moniväriset merkkikynät
- alkoholia
- kahvin suodatinpaperi
- kuppi (lasi kokeen seurannan helpottamiseksi)
Kuinka tehdään
- Käytä saksia ja leikkaa suodatinpaperi. Tee jokaiselle käytetylle kynälle suorakulmio.
- Piirrä nyt ympyrä valitsemallasi värikynällä noin 2 cm: n etäisyydelle pohjasta ja maalaa kaikki sisäpuolet.
- Liimaa paperin reuna kauimpana vedetystä marmorista alustalle. Tätä varten voit käyttää teippiä ja liittää sen lyijykynään.
- Lisää lasiin alkoholia, ei liikaa, koska sen pitäisi koskettaa vain paperin päätä lähellä kynän merkkiä.
- Aseta paperi kuppiin pystysuoraan. Kynän, joka tukee sitä, tulisi olla reunojen päällä.
- Odota 10-15 minuuttia, kunnes alkoholi nousee suodatinpaperin läpi. Sen jälkeen poista paperit ja anna niiden kuivua.
Tulos
Kun alkoholi kulkee kynän merkin läpi, se on vuorovaikutuksessa värikomponenttien kanssa ja ajaa ne paperin läpi. Eri pigmentit erotetaan siten kosketuksessa alkoholin kanssa.
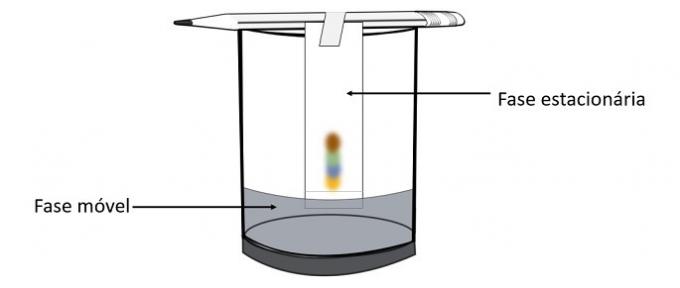
Tämän kokeen avulla on mahdollista tietää, mitkä värit sekoitettiin kynän värin luomiseksi.
Selitys
Kromatografia on eräänlainen menetelmä seosten erottamiseksi. Suodatinpaperi on kiinteä faasi ja alkoholi on liikkuva faasi, joka vetää seoksen komponentteja kulkiessaan paikallaan olevan vaiheen läpi. Tässä prosessissa, mitä suurempi vuorovaikutus alkoholin kanssa on, sitä nopeammin pigmentti liikkuu liuottimen kulkiessa.
Materiaalin ainesosat, koska niillä on erilaiset ominaisuudet, ovat vuorovaikutuksessa liikkuvan faasin kanssa eri tavoin, mikä voidaan havaita paikallisen vaiheen eri vetoaikoilla.
Lisätietoja kromatografia.
2. kokemus - ruoan säilyttäminen
Käsitteet: orgaaniset yhdisteet ja kemialliset reaktiot
Materiaalit
- omena, banaani tai päärynä
- sitruuna- tai appelsiinimehu
- C-vitamiinitabletti
Kuinka tehdään
- Valitse yksi kolmesta hedelmästä ja leikkaa se kolmeen yhtä suureen osaan.
- Ensimmäinen kappale toimii vertailuna muihin. Joten älä lisää siihen mitään, jätä se vain ilmalle.
- Tiputa yhteen paloihin sitruunan tai appelsiinin sisältö. Levitä niin, että koko hedelmän sisäosa on peitetty mehulla.
- Viimeisessä osassa levitä C-vitamiini, se voi olla murskattu tabletti koko hedelmälihalla.
- Katso mitä tapahtuu ja vertaa tuloksia.
Tulos
Ilmassa altistuneen hedelmän massan tulisi tummentua nopeasti. Sitruuna- tai appelsiinimehun ja C-vitamiinin, kemikaalin, jota kutsutaan askorbiinihapoksi, pitäisi hidastaa hedelmien ruskistumista.

Selitys
Kun leikkaamme hedelmän, sen solut vaurioituvat vapauttaen entsyymejä, kuten polyfenolioksidaasia, joka sisään kosketus ilman kanssa hapettaa ruoassa olevat fenoliyhdisteet ja aiheuttaa entsymaattisen ruskistumisen.
Hapen vaikutuksen estämiseksi käytetään säilöntäaineita, kuten askorbiinihappoa, koska ne hapetetaan ensisijaisesti fenoliyhdisteiden sijasta. C-vitamiinitabletin lisäksi askorbiinihappoa on läsnä kokeessa ehdotetuissa luonnollisissa lähteissä, kuten sitrushedelmissä, sitruunassa ja appelsiinissa.
Lisätietoja hapettuminen.
Kolmas kokemus - kuka jäätyy nopeammin?
Käsitteet: kolligatiiviset ominaisuudet ja kryoskopia
Materiaalit
- kaksi putkea (käytetään juhlatilaisuuksiin)
- lasikulho
- pöytäsuola
- suodatettua vettä
- jäätä
- lämpömittari
Kuinka tehdään
- Lisää sama määrä suodatettua vettä molempiin putkiin. Esimerkiksi 5 ml kussakin putkessa.
- Lisää pöytäsuola yhteen putkista ja aseta tunniste teipillä erottaaksesi suolaisen.
- Täytä lasiastia murskatulla jäällä ja lisää suolaa.
- Aseta kaksi putkea samanaikaisesti jään sisälle ja seuraa mitä tapahtuu.
- Kirjaa jäätymislämpötila jokaiselle tilanteelle.
Tulos
Liuotetun aineen lisääminen veteen alentaa jäätymislämpötilaa. Siksi tavallisella vedellä on taipumus jäätyä paljon nopeammin kuin suola- ja vesiliuoksella, kun se altistetaan samoille olosuhteille.
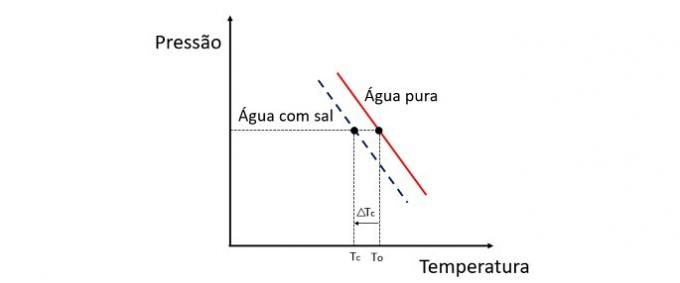
Selitys
Kroskopia on kolligatiivinen ominaisuus, joka tutkii liuottimen lämpötilan vaihtelua, kun siihen liuotetaan erilaisia määriä liuenneita aineita.
Veden jäätymislämpötilan laskeminen johtuu haihtumattomasta aineesta, ja tällä ilmiöllä on monia käytännön sovelluksia. Siksi suurempi liuenneen aineen pitoisuus liuoksessa vaikuttaa kryoskooppiseen vaikutukseen.
Jos esimerkiksi vesi jäätyy 0 ° C: n lämpötilassa ja siihen lisätään suolaa, vaihemuutoslämpötila on negatiivinen eli paljon alhaisempi.
Siksi merivesi ei jääty paikoissa, joiden lämpötila on alle 0 ° C. Veteen liuotetulla suolalla on taipumus alentaa jäätymislämpötilaa edelleen. Paikoissa, joissa on lunta, on myös tavallista heittää suolaa teille sulattaa jäätä ja välttää onnettomuuksia.
Lisätietoja kolligatiiviset ominaisuudet.
4. koe - vetyperoksidin hajoaminen
käsitteet: kemiallinen reaktio ja katalyytti
Materiaalit
- Puolet raakaa perunaa ja puolet keitettyä
- Pala raakaa maksaa ja toinen keitetty pala
- Vetyperoksidi
- 2 ruokalajia
Kuinka tehdään
- Lisää jokaiseen ruokalajiin ruoka, perunat yhdessä ja maksa yhdessä.
- Kuhunkin neljästä materiaalista lisätään 3 tippaa vetyperoksidia.
- Katso mitä tapahtuu ja vertaa tuloksia.
Tulos
Vetyperoksidi, vetyperoksidiliuos, joutuessaan kosketuksiin raakojen elintarvikkeiden kanssa alkaa kuohtua melkein välittömästi.
Tämä koe voidaan tehdä myös lisäämällä pala ruokaa vetyperoksidia sisältävään astiaan reaktion havaittavuuden lisäämiseksi.
Selitys
Vetyperoksidin aiheuttama kuohunta, kun se joutuu kosketuksiin raakojen elintarvikkeiden kanssa, luonnehtii kemiallisen reaktion tapahtuminen, joka on vetyperoksidin hajoaminen ja kaasun vapautuminen happi.
Vetyperoksidin hajoaminen tapahtuu eläin- ja kasvisoluissa läsnä olevan peroksisomiorganellissa olevan katalaasientsyymin vaikutuksesta.
On tärkeää korostaa, että vetyperoksidin hajoaminen tapahtuu spontaanisti, auringonvalon läsnä ollessa, mutta hyvin hitaasti. Katalaasi toimii kuitenkin katalysaattorina, mikä lisää kemiallisen reaktion nopeutta.
Vetyperoksidi voi olla myrkyllinen aine soluille. Siksi katalaasi hajottaa yhdisteen ja tuottaa vettä ja happea, kaksi ainetta, jotka eivät vahingoita kehoa.
Kun ruoka kypsennetään, sen komponentit muuttuvat. Keittämisen aiheuttamat modifikaatiot vaarantavat myös katalaasin toiminnan denaturoimalla proteiinia.
Sama toiminta, jonka näemme ruoan kanssa, tapahtuu, kun laitamme vetyperoksidia haavaan. Katalaasi toimii ja muodostuu kuplia, mikä koostuu hapen vapautumisesta.
Lisätietoja kemialliset reaktiot.
Bibliografiset viitteet
SAINTS, W. L. P.; MOL, G. S. (Coords.). Kansalaisten kemia. 1. toim. São Paulo: Uusi sukupolvi, 2011. v. 1, 2, 3.
BRAZILIAN KEMIALLISET YHTEISKUNNAT (organisaatio) 2010. Kemia lähelläsi: Edulliset kokeilut K-12-luokkahuoneelle. 1. toim. Sao Paulo.

