Hapot ja emäkset ovat kaksi toisiinsa liittyvää kemiallista ryhmää. Ne ovat kaksi erittäin tärkeätä ainetta, joita esiintyy jokapäiväisessä elämässä.
Happoja ja emäksiä tutkii epäorgaaninen kemia, haara, joka tutkii yhdisteitä, joita ei muodostu hiilestä.
Happojen ja emästen käsitteet
Arrheniuksen käsite
Yksi ensimmäisistä happojen ja emästen käsitteistä kehitti 1800-luvun lopulla ruotsalainen kemisti Svante Arrhenius.
Arrheniusin mukaan hapot ovat aineita, jotka kärsivät vesiliuoksessa ionisaatio, vapauttamalla kationeina vain H +.
HCl (vesiliuos) → H+ (aq) + Cl- (tässä)
Emäkset ovat aineita, jotka kärsivät ioninen dissosiaatiovapauttaen ainoana anionityyppinä OH- (hydroksyyli) -ionit.
NaOH (vesiliuos) → Na+ (aq) + OH- (tässä)
Arrheniuksen käsite hapoista ja emäksistä rajoittui kuitenkin veteen.
Lue myös: Arrhenius-teoria ja Neutralointireaktio.
Bronsted-Lowry -konsepti
Bronsted-Lowry -konsepti on laajempi kuin Arrhenius, ja se otettiin käyttöön vuonna 1923.
Tämän uuden määritelmän mukaan hapot ovat aineita, jotka kykenevät luovuttamaan protonia H
+ muihin aineisiin. Emäkset ovat aineita, jotka kykenevät hyväksymään H-protonin+ muiden aineiden kanssa.Tuo on happo on protonidonori ja emäs on protonireseptori.
Se kuvaa a vahva happo sellaisenaan, joka ionisoituu kokonaan vedessä, eli vapauttaa H-ioneja+.
Aine voi kuitenkin olla amfiproottinen, eli pystyy käyttäytymään kuten a happo tai Bronsted-pohja. Katso esimerkki vedestä (H2O), amfiproottinen aine:
HNO3(aq) + H2O(l) → EI3- (aq) + H3O+(aq) = pronssinen pohja, hyväksyi protonin
NH3(aq) + H2O(l) → NH4+(aq) + OH-(aq) = pronssinen happo, luovutti protonin
Lisäksi aineet käyttäytyvät kuten konjugaattiparit. Kaikki reaktiot hapon ja a pohja Bronstediin liittyy protonin siirto ja niillä on kaksi konjugoitua happo-emäsparia. Katso esimerkki:
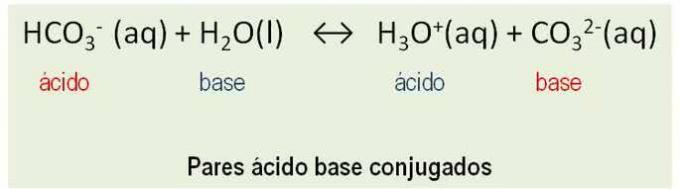
HCO3- ja CO32-; H2O ja H3O+ ovat konjugaattihappoemäsparit.
Lisätietoja:
- Epäorgaaniset toiminnot
- Happopohjaiset indikaattorit
- Titraus
Happojen nimikkeistö
Nimikkeistön määrittelemiseksi hapot jaetaan kahteen ryhmään:
- Hydridit: hapot ilman happea;
- Happohapot: hapon hapot.
Hidrasidit
Nimikkeistö esiintyy seuraavasti:
happo + alkuaineen nimi + vesipitoinen
Esimerkkejä:
HCl = suolahappo
HI = hydriodihappo
HF = fluorivetyhappo
oksihapot
Happojen nimikkeistö noudattaa seuraavia sääntöjä:
Sinä standardihapot jokaisen perheen (jaksollisen taulukon perheet 14, 15, 16 ja 17) perhe noudattaa yleistä sääntöä:
happo + alkuaineen nimi + ic
Esimerkkejä:
HClO3 = kloorihappo
H2VAIN4 = rikkihappo
H2CO3: hiilihappo
Muille hapoille, jotka muodostuvat samalla ydinelementillä, nimämme ne hapen määrän perusteella seuraavan säännön mukaisesti:
| Hapen määrä suhteessa standardihappoon | Nimikkeistö |
|---|---|
| + 1 happea | Happo + per elementin nimi + ico |
| - 1 happea | Happo + alkuaineen nimi + luu |
| - 2 oksigeeniä | Happo + hypo + alkuaineen nimi + luu |
Esimerkkejä:
HClO4 (4 happiatomia, yksi enemmän kuin standardihappo): perkloorihappo;
HClO2 (2 happiatomia, yksi vähemmän kuin standardihappo): kloorihappo;
HClO (1 happiatomi, kaksi vähemmän kuin standardihappo): hypokloorihappo.
Saatat myös olla kiinnostunut: rikkihappo
Perusnimikkeistö
Perusnimikkeistön osalta noudatetaan yleistä sääntöä:
Hydroksidi + kationin nimi
Esimerkki:
NaOH = Natriumhydroksidia
Kuitenkin, kun sama elementti muodostaa kationit, joilla on erilaiset varaukset, ionin varauksen numero lisätään nimen loppuun roomalaisilla numeroilla.
Tai voit lisätä loppuliitteen -oso vähiten varautuneeseen ioniin ja loppuliitteen -ico eniten varattuun ioniin.
Esimerkki:
Rauta
Usko2+ = Fe (OH)2 = Rauta II -hydroksidi tai rautahydroksidi;
Usko3+ = Fe (OH)3 = Rauta III -hydroksidi tai ferrihydroksidi.
Muista tarkistaa aiheesta valintakokeita koskevat kysymykset kommentoidulla tarkkuudella: Epäorgaanisten toimintojen harjoitukset.