Fyysisen tilan muutokset riippuvat joistakin lämpötilaan, paineeseen ja prosessiin liittyvän energian määrään liittyvistä tekijöistä.
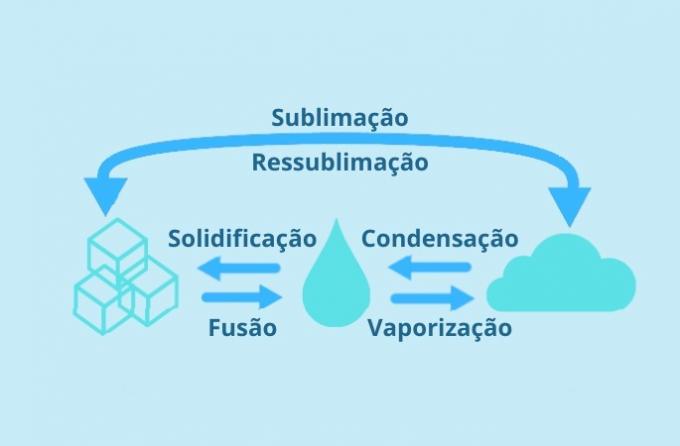
Luonnossa on kolme aineen fysikaalista tilaa: kiinteä, nestemäinen ja kaasu. Ja fyysiset tilamuutokset edustavat viittä muutosprosessia tilasta toiseen.
Muutokset ovat: kondensoituminen tai nesteyttäminen, jähmettyminen, fuusiointi, höyrystyminen ja sublimaatio. Jokaisella muutostyypillä on joitain erityispiirteitä ja ne liittyvät asian ominaisuuksiin.
Tiivistyminen
Kondensoituminen edustaa valtion kulkemista kaasumainen tai nestemäinen.
Tämä tapahtuu johtuen kaasun jäähtymisestä, joka pyrkii tiivistymään ja siitä tulee nestettä.
Kiinteytyminen
Jähmettyminen on neste kiinteään tilaan.
Nestemäisessä tilassa oleva aine jäähtyneenä pyrkii kiinteäksi. Veden tapauksessa kiinteytyminen tapahtuu 0 ° C: ssa

Fuusio
Fuusio on kiinteä tila nestemäiseksi.
Kunkin aineen molekyylit tarvitsevat tietyn määrän energiaa liikkumiseen. Kun energiaa on vähemmän, ne pyrkivät liikkumaan vähemmän ja materiaali on yleensä kiinteää.
Vastaanottaessaan energiaa lämmönlähteestä (lämmitys), heistä tulee kiihtyneempiä ja ne voivat muuttaa tilaa.

Höyrystys
Höyrystys on nestemäisestä kaasumaiseen tilaan. Tämä voi tapahtua kahdella tavalla:
- Kiehuu: nopea lämmitys.
- Haihdutus: hidas lämmitys.
1 ° C: sta 100 ° C: seen se on nestemäistä.

Sublimaatio
Sublimaatio on kiinteästä tilasta kaasumaiseksi Se on lähtöisin kaasumainen tila kiinteään (uudelleenlevittäminen).
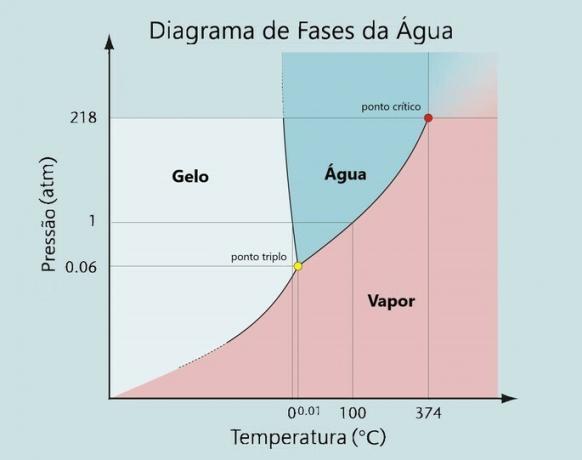
Tämän tyyppinen muutos tapahtuu tietyistä paine- ja lämpötilaolosuhteista riippuen. Jokaisella elementillä on oma Vaihekaavio, jossa sen fuusio-, höyrystymis- ja sublimaatiokäyrät sijaitsevat.

Veden fysikaaliset tilat
Vesi on helposti löydettävissä kolmesta fysikaalisesta tilastaan: kiinteä, nestemäinen ja kaasu.
Jokainen veden fyysinen tila on mahdollinen lämpötilan ja paineen vaihteluiden mukaan.
Normaalipaineessa (1atm) vesi sulaa 0 ° C: ssa ja kiehuu 100 ° C: ssa.
Vesimolekyylit -1 ° C: ssa ovat kiinteässä tilassa ja 0 ° C: ssa tapahtuu muutos (sulamispiste) jäästä 0 ° C: ssa vedeksi 0 ° C: ssa.
Kun se saavuttaa 100 ° C: n lämpötilan, se käy läpi uuden tilanmuutoksen (höyrystyminen) siirtymällä nesteestä kaasumaiseen tilaan.
Kuten sen vaihekaaviosta voidaan nähdä:
Jos haluat oppia lisää aiheesta, lue myös:
- Veden fyysiset tilat
- Aineen fyysiset tilat
- Fysikaaliset ja kemialliset muunnokset
- Fysikaaliset ja kemialliset ilmiöt