Pintajännitys on ilmiö, joka esiintyy nesteiden, kuten veden, pinnalla, jolloin muodostuu ohut kalvo.
Kun vesi nestemäisessä tilassa on säiliö, voimme havaita nesteen ja ympäristön välisen eron. Tämä johtuu siitä, että pinnan vesimolekyylien välinen vuorovaikutus eroaa nesteen sisäisistä vuorovaikutuksista.
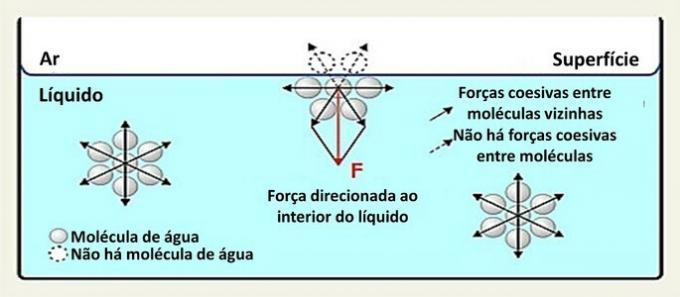
Pinnalla vesimolekyyli on vuorovaikutuksessa sen sivuilla ja alapuolella olevien molekyylien kanssa. Sisällä molekyyliä ympäröivät muut molekyylit, ja vety-sidosten kautta tapahtuu vuorovaikutusta kaikkiin suuntiin.
Tämän ominaisuuden takia havaitsemme pisaran muodostumisen ilmiön. Tämän vuoksi hyönteiset voivat myös kävellä veden päällä.
Mikä on pintajännitys?
Se on ohuen kalvon muodostuminen nesteen alle johtuen sen muodostavien molekyylien välisestä vetovoimasta. Tämä ilmiö esiintyy selvemmin nesteissä, joilla on molekyylien väliset voimat voimakas, kuten vesi.
Nesteessä olevien lajien välisiä vuorovaikutuksia kutsutaan yhteenkuuluviksi voimiksi. Nesteen sisällä olevat molekyylit vetävät puoleensa naapurimolekyylit kaikkiin suuntiin, mutta pinnalla olevat molekyylit ovat vuorovaikutuksessa niiden alapuolella ja vieressä olevien molekyylien kanssa.
Katso kuinka pintajännitys tapahtuu vedessä.
Vesi (H2O) on napamolekyyli, jonka muodostavat 2 vetyatomia (positiiviset navat) ja yksi happiatomi (negatiivinen napa) kovalenttiset sidokset. Molekyylin positiivinen napa vetää naapurimolekyylin negatiivista napaa muodostaen vetysidoksia.
Tämän tyyppinen vuorovaikutus nesteen sisällä jakautuu kaikkiin suuntiin. Pinnalla voimat suuntautuvat alaspäin ja sivuttain, koska niiden yläpuolella ei ole vesimolekyylejä. Tämä tekee pintamolekyyleistä yhtenäisemmän ja luo elastisen kalvon.
Pintajännitysyksikkö saadaan voimayksikön ja pituusyksikön välisestä osamäärästä, joista eniten käytetään dyne / senttimetri (dyne / cm) ja newton / metri (N / m).
Vedellä on suuri pintajännitys, jonka arvo on 72,75 dyne / cm. Elohopean, nestemäisen metallin, pintajännitys on kuitenkin noin 7 kertaa suurempi kuin vedellä, 475 dyne / cm.
Haluatko tietää enemmän? Joten tarkista seuraavat tekstit:
- Veden ominaisuudet
- Polaariset ja apolaariset molekyylit
- Kemialliset sidokset
Pintajännityksen aiheuttamat ilmiöt
Pintajännitys on vastuussa joistakin arkielämässä havaitsemistamme ilmiöistä. Tärkeimmät ovat:
Eläimet, jotka kävelevät vedellä

Hyönteiset, hämähäkit ja muut eläimet voivat kävellä tai levätä Vesi koska käpäliensä raajoissa on rasvaisella aineella päällystettyjä karvoja, eivätkä ne siksi pääse tunkeutumaan pinnalle liittyneiden vesimolekyylien väliin.
Vesipisaroiden muodostuminen

Vesipisarat ovat pallomaisia, koska ne ovat supistuneet molekyylejä pinnan jännityksen aiheuttama pinta-ala. Pallo esiintyy, koska tämä on geometrinen muoto, jossa pinta-alan ja tilavuuden välillä on pienin suhde. Siksi pallomainen muoto pitää pienimmän määrän vesimolekyylejä kosketuksessa ilman kanssa.
Harjoituksia veden pintajännitykselle
1. Pinta-aktiivinen aine on aine, joka vaikuttaa toiseen muuttuakseen:
a) Osmolaarisuus.
b) Pintajännitys.
c) Elektroforeesi.
d) Viskositeetti.
e) Osmoottinen paine.
Oikea vaihtoehto: b) Pintajännitys.
a) VÄÄRIN. Osmolaarisuus liittyy tiettyyn liuottimen tilavuuteen sisältyvien liuenneiden hiukkasten määrään.
b) OIKEA. Sekä pesuaineet että saippuat alentavat veden pintajännitystä ja niitä kutsutaan yleisesti pinta-aktiiviset aineet, koska näiden materiaalien molekyylit sijoitetaan vesimolekyylien väliin ja vähentävät jännitystä pinnallinen.
c) VÄÄRIN. Elektroforeesi on tekniikka molekyylien erottamiseksi niiden varausten mukaan.
d) VÄÄRIN. Viskositeetti on fysikaalinen ominaisuus, joka määrittää nesteen virtausvastuksen.
e) VÄÄRIN. Osmoottinen paine on kolligatiivinen ominaisuus, joka vastaa järjestelmään kohdistuvaa painetta osmoosin spontaanin esiintymisen estämiseksi.
Lisätietoja tämän numeron kattamista aiheista:
- Aineen ominaisuudet
- Kollektiiviset ominaisuudet
- Osmoottinen paine
2. Nesteiden pintajännitys riippuu suoraan molekyylien välisistä vuorovaikutusprosesseista, kuten esimerkiksi vetysidoksesta. Millä alla olevista aineista on suurin pintajännitys?
a) bentseeni
b) oktaani
c) etyylialkoholi
d) hiilitetrakloridi
e) etaanihappo
Oikea vaihtoehto: e) etaanihappo.
a) VÄÄRIN. Bentseeni on hiilivety, ei-polaarinen molekyyli, eikä se muodosta vetysidoksia.
b) VÄÄRIN. Oktaani on hiilivety ja siksi se on ei-polaarinen molekyyli, joka ei muodosta vetysidoksia.
c) VÄÄRIN. Etyylialkoholi on hieman polaarinen yhdiste, joka voi muodostaa vetysidoksia, mutta vuorovaikutus molekyylien välillä on rajallinen.
d) VÄÄRIN. Hiilitetrakloridi on ei-polaarinen orgaaninen yhdiste eikä siten muodosta vetysidoksia.
e) OIKEA. Karboksyylihappofunktionaalinen ryhmä (-COOH) voi muodostaa vetysidoksia joko hapen tai hydroksyylivedyn kanssa.

Lisätietoja tämän numeron kattamista aiheista:
- Molekyylien napaisuus
- Orgaaniset toiminnot
- Hiilivedyt
pintajännityskoe
Katso alla oleva video kokeilulla, joka osoittaa veden pintajännityksen.