Proteiinirakenne viittaa sen luonnolliseen konformaatioon, joka on tarpeen sen biologisten toimintojen suorittamiseksi.
Proteiinit ovat makromolekyylejä, jotka muodostuvat aminohappojen yhdistyessä.
Aminohapot liitetään toisiinsa peptidisidoksilla. Aminohappojen liittymisestä syntyviä molekyylejä kutsutaan peptideiksi.
Proteiineilla on neljä rakenteellista tasoa: primaarinen, sekundaarinen, tertiäärinen ja kvaternaarinen rakenne.
Proteiinien primaarirakenne
Ensisijainen rakenne vastaa lineaarinen aminohapposekvenssi liittyneet peptidisidoksilla.
Joissakin proteiineissa yhden aminohapon korvaaminen toisella voi aiheuttaa sairauden ja jopa kuoleman.
Proteiinien tilarakenteet
Proteiinien spatiaaliset rakenteet johtuvat proteiinisäikeen taittumisesta ja taittumisesta itseensä.
Proteiinien toiminnalliset ominaisuudet riippuvat niiden avaruusrakenteesta.
Toissijainen rakenne
Toissijainen rakenne vastaa kierukkakäämityksen ensimmäistä tasoa.
Sille on ominaista säännölliset ja toistuvat mallit, jotka esiintyvät paikallisesti, mikä johtuu tiettyjen läheisten aminohappoatomien välisestä vetovoimasta.
Kaksi yleisintä sekundaarirakennetta vastaavaa paikallista järjestelyä ovat alfa-helix ja beeta-lehti tai beeta-laskostettu.
- alfa-heliksin konformaatio: tunnettu kolmiulotteisesta järjestelystä, jossa polypeptidiketju olettaa kierteisen konformaation kuvitteellisen akselin ympäri.
- beeta-arkin muodonmuutos: tapahtuu, kun polypeptidiketju ulottuu siksak-muodossa ja voidaan järjestää vierekkäin.
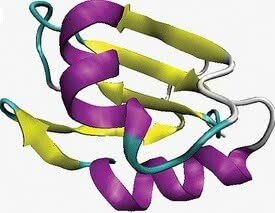
Toissijainen rakenne. Purppurassa alfa-heliksin konformaatio ja keltaisessa beeta-lehti
Tertiäärinen rakenne
Tertiäärinen rakenne vastaa polypeptidiketjun taittumista itsessään.
Tertiäärisessä rakenteessa proteiini saa tietyn kolmiulotteisen muodon johtuen koko polypeptidiketjun globaalista taittumisesta.
Kvaternaarinen rakenne
Vaikka monet proteiinit muodostuvat yhdestä polypeptidiketjusta. Toiset koostuvat useammasta kuin yhdestä polypeptidiketjusta.
Kvaternaarinen rakenne vastaa kahta tai useampaa polypeptidiketjua, identtisiä tai ei, tuon ryhmän ja sopivat yhteen muodostaen proteiinin kokonaisrakenteen.
Esimerkiksi insuliinimolekyyli koostuu kahdesta toisiinsa kytketystä ketjusta. Samaan aikaan hemoglobiini koostuu neljästä polypeptidiketjusta.
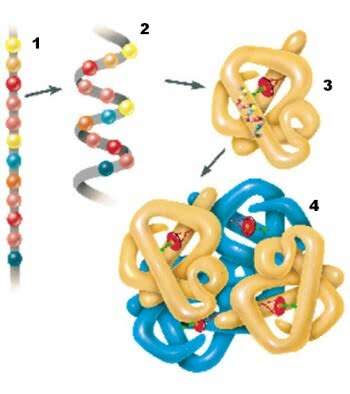
1. Ensisijainen rakenne; 2. Toissijainen rakenne; 3. Korkea-asteen rakenne; 4. Kvaternaarinen rakenne.
Lisätietoja Proteiinit.
Proteiinin denaturaatio
Biologisten toimintojensa suorittamiseksi proteiinien on esitettävä luonnollinen konformaationsa.
Lämpö, happamuus, suolapitoisuus muiden ympäristöolosuhteiden ohella voivat muuttaa proteiinien tilarakennetta. Tämän seurauksena niiden polypeptidiketjut rentoutuvat ja menettävät luonnollisen muodonsa.
Kun tämä tapahtuu, kutsumme sitä proteiinin denaturaatio.
Denaturoitumisen tulos on kyseisen proteiinin biologisen toiminnan menetys.
Aminohapposekvenssi ei kuitenkaan muutu. Denaturoituminen vastaa vain proteiinien spatiaalisen konformaation menetystä.
Jos haluat lisätietoja, lue myös aiheesta peptidit ja peptidisidokset.