Kloridit ovat niitä ioniyhdisteitä, jotka sisältävät anionin Cℓ-1.
Kloori kuuluu 17- tai 7A-perheeseen, sen atomiluku on yhtä suuri kuin 17 ja valenssikuoressa (atomin uloin elektronikuori) on 7 elektronia. Mukaan sääntö oktetin, ollakseen vakaa, sillä on oltava 8 elektronia tässä viimeisessä kuoressa ja sen vuoksi sen on vastaanotettava yksi elektroni lisää. Kun näin tapahtuu, ts. Kun se vastaanottaa elektronin, yleensä ionisidoksesta metallin kanssa, muodostuu â.ionikloridi (Cℓ-1), elektronista luopuneen metallin tulee kationi ja muodostunut aine on ioninen.
Kloridit ovat suoloja, jotka ovat peräisin emäksen reaktiosta suolahapon (HC2(tässä)). Emäs tuottaa kationin ja kloorivetyhappo kloridi-ionin:
Geneerinen emäs + suolahappo → Kloridi + vesi
ÇOH + HCℓ → ÇCℓ + H2O
Kaikki kloridit luokitellaan epäorgaaniset suolat, koska vesipitoisessa väliaineessa ne vapauttavat muun kationin kuin H+ ja vapauta kloridianioni, ei hydroksyyli (OH-).
Kloridien nimikkeistö noudattaa aina tätä sääntöä: Kloridi +
de + (klooriin liittyvän alkuaineen nimi). Klo kaavat ovat muodostuneet ionivarojen vaihtaminen indekseihin (numero, joka on elementtisymbolin oikeassa alakulmassa, mikä osoittaa sen elementin atomien lukumäärän, jotka ovat läsnä sidoksia muodostamassa).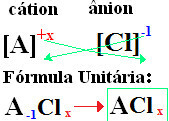
jos hakemisto on "1", sinun ei tarvitse kirjoittaa sitä kaavaan, kuten alla on esitetty:
Klo+1 Cℓ-1 → Klo1Cℓ1 → KloC2: natriumkloridi;
K+1 Cℓ-1 → KC3: kaliumkloridi;
Tässä+2 Cℓ-1→CaC22: kalsiumkloridi;
Ba+2 Cℓ-1→ Btässä2: bariumkloridi;
Aℓ+3 Cℓ-1→ACℓ3: alumiinikloridi.
Kuten tekstissä kuitenkin selitetään,Ryhmän ioniset aineet: kloridi, karbonaatti, nitraatti ja sulfaatti”, Kuten kaikkien ionisten aineiden kohdalla, kloridien yhtenäiset kaavat eivät ole luonteeltaan eristettyjä, koska niiden ionit houkuttelevat toisiaan ja muodostavat kidehilan.
Tärkein esimerkki päivittäisessä elämässämme olevasta kloridista on natriumkloridi, NaC3, pöytäsuolaa. Katso ionisidos, joka johtaa sen muodostumiseen (jossa natrium luovuttaa elektronia kloorille) ja tämän suolan kidehilan alapuolella:
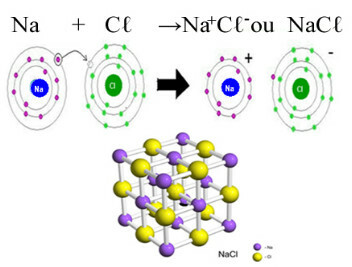
Natriumkloridin kiteisessä ristikossa kukin anioni Cℓ- ympäröi 6 kationia Na+ ja päinvastoin, joten tämän kideverkon koordinointinumero on 6.
Kaikki kloridit ovat kiinteät aineet ympäristöolosuhteissa ja melko vesiliukoinen, joka on yleisimpiä suoloja, joita löytyy jokapäiväisessä elämässämme, koska useat niistä ovat läsnä mineraalivedessä, juomavedessä, vesijohtovedessä, jokissa, merissä, muun muassa toiset. Poikkeuksena ovat veteen liukenemattomat kloridit hopeakloridi (AgCℓ - esitetty alla olevassa kuvassa), lyijy, kupari ja elohopeayhdisteet.

Veteen liukenematon hopeakloridi *
Cℓ-ionit-1 klorideista, joita nautimme, pääasiassa suola, kala ja lihaovat tärkeitä ihmiskehon joillekin toiminnoille, koska ne ovat tärkein solunulkoinen anioni, joita on mehussa mahassa, säätelevät kehon nesteitä, kuten veden jakautumista kehossa, ja pitävät plasman osmoottisen paineen ja neutraalin sähköinen.
Sen puute voi aiheuttaa ahdistusta, ripulia ja verenkierto-ongelmia. Sen ylimäärä erittyy virtsaan (keskimäärin jokainen henkilö erittää noin 4 g kloridia päivässä), hiki ja ulosteet.
*Kuvahyvitys: Kirjoittaja: Danny S. / Kuva otettu: Wikimedia Commons
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta


