Orgaaniset yhdisteet ovat molekyylisiä, toisin sanoen niiden atomeilla on kovalenttisia sidoksia keskenään. Kun analysoimme hiilen välisiä sidoksia, jotka voivat olla yksittäisiä, kaksinkertaisia tai kolminkertaisia, havaitsemme, että ne ovat ei-polaarisia sidoksia, koska atomien välillä ei ole eroa elektronegatiivisuudessa, koska ne kuuluvat samaan elementti.
Lisäksi koska vedyllä ja hiilellä on hyvin pieni elektronegatiivisuusero, niiden väliset sidokset ovat myös ei-polaarisia.
Ei-napaiset liitännät:
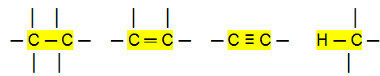
Sen avulla voimme päätellä, että Hiilivedyt (orgaaniset yhdisteet, joissa on vain hiili- ja vetyatomeja) ovat ei-polaarisia molekyylejä. Näissä yhdisteissä molekyylien välinen vuorovaikutus on indusoitua dipolityyppiä, mikä on heikointa, mitä on olemassa.
Koska nämä vuorovaikutukset ovat heikkoja, ne on helppo rikkoa. Tästä johtuen, hiilivetyjen kiehumis- ja sulamislämpötilat ovat alhaisemmat kuin muiden toimintojen.

Vertaamalla hiilivetyjä, kiehumispisteet nousevat, kun myös moolimassa kasvaa.
Esimerkiksi etaani ja butaani ovat molemmat alkaanit. Katso kunkin kokeellisesti määritetyn kiehumispisteet:
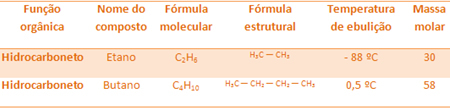
Huomaa, että butaanin kiehumislämpötila on paljon korkeampi kuin etaanin, koska myös sen moolimassa on suurempi.
Nyt kun verrataan hiilivetyjä, joilla on sama moolimassa (ne ovat isomeerejä), mutta joilla on erityyppisiä hiiliketjuja, ymmärrämme, että mitä suurempi haarojen määrä, sitä alhaisempi kiehumislämpötila, koska molekyylin rakenne tiivistyy, ts. sen pinta pienenee.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Kaikilla alla olevilla alkaaneilla on sama molekyylikaava C5H12, mutta niiden kiehumislämpötilat ovat erilaiset:
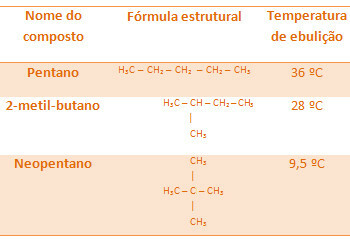
Huomaa, että neopentaanin kiehumislämpötila on matalin, koska sillä on enemmän haaroja.
Voimme ajatella, että muut orgaaniset toiminnot ovat peräisin hiilivedyistä korvaamalla yksi tai useampi vety atomien tai muiden alkuaineiden atomiryhmillä. Yleensä muissa orgaanisissa toiminnoissa on happea tai typpeä, jotka ovat enemmän elektronegatiivisia elementtejä kuin hiili. Ne houkuttelevat voimakkaammin hiilen kanssa jaettua elektroniparia ja tekevät siten molekyylistä polaarisen:
Polaariliitännät:
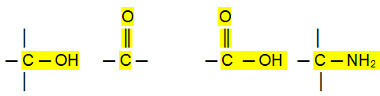
Aldehydien, ketonien ja orgaanisten halogenidien kiehumispisteet ovat korkeammat kuin hiilivetyjä, koska niiden molekyylien välinen vuorovaikutus on pysyvä dipoli, joka on vahvempi kuin indusoitu dipoli.
Alkoholien, karboksyylihappojen ja amiinien kiehumislämpötilat ovat toisaalta vielä korkeammat, koska ne suorittavat vetysidoksia, mikä on voimakkain molekyylien välinen vuorovaikutus.
Kaikkien näiden toimintojen yhdisteille pätee sama kuin hiilivetyille:

Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Orgaanisten yhdisteiden napaisuus ja kiehumislämpötila"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/polaridade-temperatura-ebulicao-dos-compostos-organicos.htm. Pääsy 28. kesäkuuta 2021.