THE Kemiallinen kinetiikka on ala, joka tutkii tekijöitä, jotka vaikuttavat kemiallisten reaktioiden kehittymisnopeuteen, ts. nopeuteen, jolla ne tapahtuvat. Tämän alueen ympärillä on yhä enemmän tutkimusta, koska haluamme usein nopeuttaa joitain reaktioita tai hidastaa toisia. Tämä on erityisen tärkeää teollisuudenaloille ja tällä tutkimuksella on merkittäviä teknisiä seurauksia.
Mutta koska reaktion nopeus voi vaihdella kullakin aikavälillä ja aineesta toiseen, on tapana laskea reaktio keskimääräinen reaktionopeus.
Harkitse seuraavaa yleistä reaktiota, jossa kertoimet ovat pieniä kirjaimia ja reagoivat aineet ja tuotteet ovat isoja kirjaimia:
a A + b B → c C + d D
Tämän reaktion keskinopeus annetaan jakamalla minkä tahansa reagoivan aineen keskimääräinen reaktionopeus tai jonkin tuotteen keskimääräinen muodostumisnopeus vastaavalla kertoimella kemiallisessa yhtälössä. Tämän antaa:
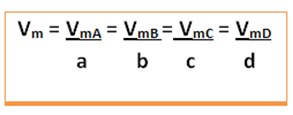
Harkitse esimerkiksi vetyperoksidin hajoamisreaktiota:
2 tuntia2O2 (aq) → 2 H2O(1) + 1 O2 g)
Sanotaan, että 1 minuutissa muodostui 0,3 mol / l H: ta
2O ja 0,15 mol / l O: ta2, kun taas 0,3 mol / l H hajosi2O2eli näiden aineiden hajoamisen ja muodostumisen keskimääräiset nopeudet reaktiossa ovat:VmH202 = 0,3 mol / l. min
VmH20 = 0,3 mol / l. min
VmO2 = 0,15 mol / l. min
Globaalin reaktion keskinopeus saadaan ottamalla yksi näistä arvoista ja jakamalla se vastaavalla kertoimella yhtälössä:
Vm = VmH202 = 0,3 mol / l. min = 0,15 mol / l. min
2 2
Vm = VmH20 = 0,3 mol / l. min = 0,15 mol / l. min
2 2
Vm = VmO2 = 0,15 mol / l. min = 0,15 mol / l. min
1 1
Huomaa, että nämä kolme arvoa ovat samat, joten reaktionopeus on sama kuin minkä tahansa reagenssin tai tuotteen funktio samalla aikavälillä.
Kuinka kuitenkin löydettiin kunkin näihin reaktioihin osallistuneen aineen keskimääräisten nopeuksien arvot?
Se voidaan laskea jakamalla aineen (reagenssin tai tuotteen) pitoisuuden vaihtelu aikavälillä. Jos aiomme määrittää yhden nopeuden keskinopeuden reagenssit reaktion, meidän on laitettava a negatiivinen merkki tai muuten harkitse pitoisuusarvoa moduulissa ||, koska reagenssin pitoisuus pienenee ajan myötä, nopeusarvo olisi negatiivinen, mutta negatiivista nopeutta ei ole.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)

Harkitse esimerkiksi seuraavaa otsonikaasun hajoamisreaktiota (O3 g)) happikaasussa (O2 g)):
2 O3 g) → 3 O2 g)
Sanotaan, että ilmapallossa oli 10 moolia otsonikaasua, mutta minuutin kuluttua jäljellä oli vain 4 moolia; tämä tarkoittaa, että 6 moolia otsonia muuttui happikaasuksi. Joten meillä on:
2 O3 g) → 3 O2 g)
t = 0 min 2 mol / L 0 mol / L
muodostuneet kulut
6 mol / L 9 mol / L
t = 1 min 4 mol / L 9 mol / L
Huomaa, että koska reaktiosuhde on 2: 3, niin jos käytettäisiin 6 moolia O: ta3Muodostui 9 mol O: ta2. Joten yhden minuutin kuluttua meillä on seuraavat keskinopeudet:
Vm = - ∆ [3]
t
Vm = - ([O3finaali - O3initial])
tLopullinen - talkukirjain
Vm = - ([4 - 10])
1– 0
Vm = 6 mol / l. min→ Yhden minuutin ajan 6 mol otsonia reagoi jokaisessa litrassa järjestelmää.
Vm = ∆ [2]
t
Vm = ([O2finaali - O2initial])
tLopullinen - talkukirjain
Vm = ([9 - 0])
1– 0
Vm = 9 mol / l. min→ Yhden minuutin aikana järjestelmän 9 litraan happea muodostui.
Tämä osoittaa meille, että voimme laskea keskimääräisen nopeuden reagenssien tai tuotteiden funktiona.
Jos haluamme nyt laskea tämän globaalin reaktion keskinopeuden, tee vain kuten alussa osoitimme: jaa kukin näistä nopeuksista vastaavilla kertoimilla kemiallisessa yhtälössä:
Vm = Vm03 = 6 mol / l. min = 3 mol / l. min
2 21
Vm = VmO2 = 9 mol / l. min = 3 mol / l. min
3 3
Vm = Vm03 = VmO2
23
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Kemiallisten reaktioiden nopeus"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm. Pääsy 27. kesäkuuta 2021.