Klo palamisreaktiot he ovat läsnä monilla arjen osa-alueilla. Esimerkiksi tärkeimmät energiantuotannon lähteet johtuvat tiettyjen polttoaineiden, kuten etanolin, bensiinin, puuhiilen, palamisesta tai polttamisesta. Lisäksi energia, jota tarvitsemme selviytymiseen ja työn tekemiseen, on seurausta palamisreaktioista, jotka tapahtuvat soluissamme, kun "poltamme" syömäämme ruokaa.
Mutta mitä tarvitaan palamisreaktion saamiseksi?
Kolme asiaa tarvitaan:
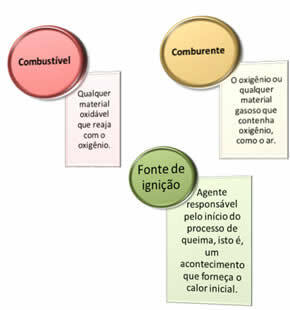
Nämä kolme tekijää muodostavat palokolmio, koska kun palamisreaktio alkaa, vapautunut energia ylläpitää reaktiota ja antaa sen jatkua, kunnes polttoaine, hapetin tai lämpö (vapautunut energia) on kadonnut. Tämä tarkoittaa, että tulee olemaan Ketjureaktio.
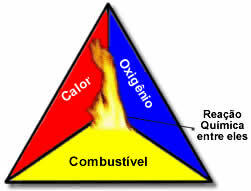
Esimerkiksi, jos joku heittää sytytetyn savukkeen metsään, tapahtuu tulipalo (palamisreaktio). Tässä tapauksessa Puska se on polttoainetta, O happea ilmassa ilmakehän on hapetin se on savuke palaa oli sytytyslähde. Tämä palaminen jatkuu, kunnes yksi kolmesta tekijästä eliminoidaan. Jos palomiehet heittävät vettä, lämpö poistuu. Mutta vaikka mitään ei tehdä tämän polttamisen lopettamiseksi, se loppuu jossain vaiheessa, ts. Kun polttoaine (metsä) loppuu.
Kuten jo mainittiin, näissä reaktioissa vapautuu lämpöä, joten palaminen on eksoterminen reaktio. Tämän tyyppinen reaktio on kuitenkin epätäydellinen palaminen. Jos haluat ymmärtää miksi, katso ero täydellisen ja keskeneräisen palamisen välillä:
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Täysi palaminen:
Analysoimalla orgaanisia yhdisteitä polttoaineina meidän on
| THE täydellinen palaminen se tapahtuu, kun hiiliketju rikkoutuu ja kaikki hiiliketjun hiiliatomit ovat täysin hapettuneet. |
| Sinä muodostuneet tuotteet hiilivetyjen kautta CO2 (hiilidioksidi) ja H2O (Vesi). |
Huomioi isoktaanin, joka on yksi bensiinin komponentti, täydellinen palaminen.
Ç8H18 (g) +25/2 O2 g) → 8 CO2 g) + 9 am2O(1)
Keskeneräinen palaminen
| Tässä tapauksessa hapettimia ei ole tarpeeksi eli happea tarpeeksi kaiken polttoaineen polttamiseen. |
| Täten muodostuneet tuotteet ovat CO (hiilimonoksidi) ja H2O. |
Huomaa sama isoktaanin palaminen, kuitenkin nyt epätäydellisesti:
Ç8H18 (g) + 17/2 O2(g) → 8 CO (g) + 9 am2O(1)
Metsien polttaminen on esimerkki, koska tuloksena olevat päästöt koostuvat CO: sta ja tietyistä aineista, kuten nokesta (C), tuhkasta ja muista yksinkertaisista ja monimutkaisista orgaanisista yhdisteistä. Typpioksidia, otsonia ja aldehydejä voi muodostua myös toissijaisten reaktioiden seurauksena, koska ilmassa on muita komponentteja.
Ç8H18 (g) + 9/2 O2 g) → 8C (g) + 9 am2O(1)
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Brasilian koulutiimi
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Täydellinen ja epätäydellinen palaminen"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/combustao-completa-incompleta.htm. Pääsy 27. kesäkuuta 2021.


