Kovalenttisidos on eräänlainen vuorovaikutus atomien välillä, joilla on korkea elektronegatiivisuus, ts. suuri taipumus vastaanottaa elektroneja. Tämäntyyppiseen sidokseen yleisesti liittyvät kemialliset alkuaineet ovat:
Vety (H)
Beryllium (Be)
Boori (B)
Hiili (C)
Typpi (N)
Fosfori (P)
Happi (O)
Rikki (S)
Fluori (F)
Kloori (Cl)
Bromi (Br)
Jodi (I)
a) mukana olevien elementtien luonne
Kemialliset alkuaineet, joilla on korkea elektronegatiivisuus ja jotka siten aiheuttavat kovalenttisia sidoksia, ovat:
Vety
Ametals
b) Kovalenttisen sidoksen esiintyminen
Kovalenttisessa sidoksessa olevien kemiallisten alkuaineiden luonteesta riippuen se voi tapahtua seuraavasti:
Kahden vetyatomin välillä;
Ei-metalliatomin ja vedyn välillä;
Saman kemiallisen elementin (ei-metallin) atomien välissä;
Eri kemiallisten alkuaineiden (molemmat ei-metallien) atomien välillä.
c) Elektronien määrä, jonka jokaisen atomin on vastaanotettava
Elektronien lukumäärä, jonka kukin ei-metalli- tai vetyatomi saa sidokseen, on suhteessa oktetin sääntö.
Oktetisäännön mukaan atomi on vakaa, kun se saa kahdeksan tai kaksi elektronia (vain vedyn tapauksessa) valenssikuoressa. Jos atomin valenssikuoressa on esimerkiksi viisi elektronia, sen on vastaanotettava kolme elektronia vakauden saavuttamiseksi.
HUOMAUTUS: Beryllium ja boori ovat poikkeuksia oktettisäännöstä, kun niistä tulee vakaa, vastaavasti, 4 ja 6 elektronia valenssikuoressa.
Elektronien lukumäärä valenssikuoressa voidaan helposti määrittää analysoimalla kemiallisten elementtien perhe. Alla olevassa taulukossa meillä on valenssikuoressa olevien elektronien määrä, joka viittaa perheeseen, johon elementti kuuluu, ja elektronien lukumäärä, jonka sen on vastaanotettava vakauden saavuttamiseksi:

d) Kovalenttisen sidoksen periaate
Kuten kovalenttisessa sidoksessa, kaikilla mukana olevilla atomeilla on taipumus vastaanottaa elektroneja pakollisesti, niiden välillä on jaettu valenssikuoressa (ytimestä kauimpana oleva taso) läsnä olevat elektronit.
Jakaminen tapahtuu, kun atomin valenssikuoresta tulevasta elektronista tulee osa samaa elektronista pilviä, joka ympäröi toista elektronia toisen atomin valenssikuoresta.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Jokaisella vetyatomilla on esimerkiksi elektroni valenssikuoressa. Kun kahdesta elektronista tulee osa samaa pilviä, kullakin vedyllä alkaa olla kaksi valenssielektronia, eli se stabiloituu.
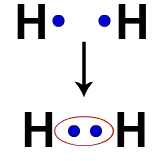
Kahden vetyatomin elektronit miehittävät saman elektronipilven
e) Kovalenttisessa sidoksessa käytetyt kaavat
1ª) molekyylikaava
Se osoittaa kovalenttisista sidoksista peräisin olevan molekyylin muodostavien jokaisen elementin atomien lukumäärän.
Esimerkki: H2O
Vesimolekyylissä meillä on 2 vetyatomia ja 1 happiatomi.
2ª) rakennekaava
Rakennekaava on osoitus molekyylin organisaatiosta, eli se osoittaa atomien väliset siteet. Tätä varten käytetään viivoja, jotka edustavat kunkin atomin sidosta:
Yksinkertainen (?): Ilmaisee, että atomi jakoi vain yhden elektronin valenssikuorestaan toisen atomin kanssa ja päinvastoin;
Kaksinkertainen (?): Ilmaisee, että atomi jakoi kaksi elektronia valenssikuorestaan toisen atomin kanssa ja päinvastoin;
Kolminkertainen (≡): Ilmaisee, että atomi on jakanut kolme elektronia valenssikuorestaan toisen atomin kanssa ja päinvastoin.
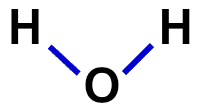
Veden rakennekaava
3ª) Lewisin elektroninen kaava
Lewisin elektroninen kaava edustaa myös molekyylin organisaatiota (elektroninen kaava), mutta sen tarkoituksena on osoittaa elektronien jakautuminen atomissa.
Sen rakentamiseksi riittää kunnioittamaan rakennekaavassa ehdotettua organisaatiota ja korvaamaan jokaisen sidoksen jälki (yksi-, kaksinkertainen tai kolminkertainen) "kahdella pallolla", jotka edustavat elektroneja.
Esimerkiksi veden rakennekaavassa meillä on kaksi yksinkertaista sidosta vetyjen ja hapen välillä. Niiden välissä meillä on siis vain kaksi palloa, jotka on rajattu ellipsillä (joka edustaa elektronista pilviä).
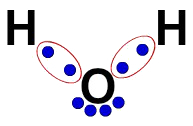
Lewisin sähköinen kaava vedestä
Minun luona. Diogo Lopes Dias
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
PÄIVÄT, Diogo Lopes. "Mikä on kovalenttinen sidos?"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-covalente.htm. Pääsy 28. kesäkuuta 2021.
