entropia on a suuruustermodynamiikka liittyvä peruuttamattomuus fyysisen järjestelmän tiloista. Se liittyy yleisesti "häiriö"Tai"satunnaisuus”Järjestelmän. Yhden lausunnon mukaan 2. termodynamiikan laki:
“Lämpöeristetyssä järjestelmässä entropian mittauksen tulisi aina kasvaa ajan myötä, kunnes se saavuttaa maksimiarvonsa. "
Toisin sanoen haje osaa mitata "ajan nuoli”Järjestelmän. Kun näemme alla olevat kuvat, tiedämme intuitiivisesti, että järjestelmän alkutilaa edustaa järjestelmän kuva vasemmalle, suurimmista organisaatio:
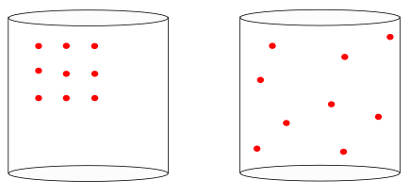
Tarkasteltaessa edellistä kuvaa tiedämme, että todennäköisin lopullinen kokoonpano on se, jossa atomit ovat nopeudet kaikkiin suuntiin, yhtä hyvin kuin satunnaiset kannat. Siitä entropia on kyse: a moninaisuus järjestelmän tiloista täytyy aina kasvaa.
Esimerkkejä
Mikä alla olevista asetuksista on todennäköisempi on noudatettava tiilien järjestelyä ajan myötä?

Ensimmäisessä kokoonpanossa moninaisuus lohkojen tiloista on vähän: ne kaikki on järjestetty suuntavaakasuorassa,
rinnakkain toisiaan. Ajan myötä tai agentin toiminnan odotetaan olevan sen kokoonpano kasva aikuiseksi sisään määrä sisään Osavaltiot, suosimalla maanantaikonformaatio, havainnollistettu oikealla olevassa kuvassa. Muita esimerkkejä voidaan antaa:-
Kun jääpakkaus asetetaan astiaan suurempilämpötila, sen lämpötila nousee, kunnes se saavuttaa lämpötilan terminen tasapaino. Siinä vaiheessa jää voi sulaa. Ottamalla lämpöä jälleen jääpalasta, joka on nyt tilassa neste, se voi tulla jälleen kiinteäksi, mutta sen muoto ei ole samaa organisaatiota aiemmin esitetty.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Kun avaamme pullon hajuvettä, lämpö voi auttaa diffuusio sinun molekyylit, hajusteiden sisällön levittäminen koko huoneen pituudelle. Päinvastaista ei voida odottaa, koska lämmön poisto ei edistäisi molekyylien paluuta pulloon.
Entropian matemaattinen määritelmä
THE matemaattinen määritelmä entropia saadaan lämmön määrän suhteella (Q) siirretään lämpöeristetyn järjestelmän kahden osan välillä, in joulea (J) absoluuttisen lämpötilan perusteella, Kelvin (K):

S = Entropia (J / K)
ΔQ = Lämmön määrä (J)
T = Absoluuttinen lämpötila (K)
Edellä esitetty määritelmä on voimassa isotermiset prosessit, ts. missä lämmönvaihto on niin pientä (tai hidasta), että ne eivät pysty muuttamaan järjestelmän lämpötilaa. Entropian määritelmä on näin äärettömän pieni (äärettömän pieni osa).
Voimme myös ymmärtää entropian käsitteen seuraavasti: se on järjestelmä, joka muodostuu kahdesta saman kaasun osasta sisään monta erilaistalämpötiloissa, on mahdollista uuttaa jonkin verran työ hänen siirtävän joitain mäntä tai käsiveivi, esimerkiksi. Kuitenkin, ajan myötä, tämän kaasun osat pyrkivät saldolämpö. Jos lämpötilaeroa ei enää ole, vaikka siellä olisi kaikki energia, ei ole mahdollista uuttaa mitään työhyödyllinen häneltä.
Kirjailija: Rafael Hellerbrock
Valmistunut fysiikasta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
HELERBROCK, Rafael. "Mikä on entropia?"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-entropia.htm. Pääsy 28. kesäkuuta 2021.


