Kun sanomme sanan "tasapaino", mieleen tulee objekti, joka on pysyvästi jäljellä. Tämä on kuitenkin vain eräänlainen tasapaino, nimeltään "Staattinen tasapaino".
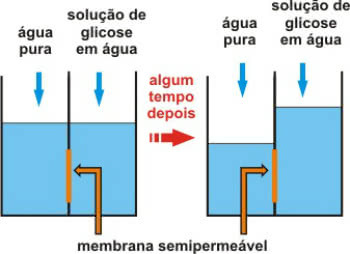
Siellä on myös "dynaamisessa tasapainossa". Siinä, kuten nimi sanoo, ei ole yhtäkään hetkeä, jolloin kyseinen esine tai ilmiö olisi edelleen. Esimerkiksi ymmärtääksesi, katso alla oleva kuva ja huomaa, että astiaan putoavan veden määrä on yhtä suuri kuin siitä virtaava määrä pitämällä veden taso vakiona. Siinä tapauksessa sanomme, että on dynaaminen tasapaino, tasapaino liikkeessä.

Tällainen tasapaino tapahtuu palautuvat reaktiot, eli niissä reaktioissa, jotka tapahtuvat molempiin suuntiin. Samalla kun reagoivien aineiden molekyylit muunnetaan tuotteiksi, tuotteiden molekyylit reagoivat toistensa kanssa muodostaen reagoivat aineet. Reaktion palautuvuutta edustavat nuolet molempiin suuntiin:
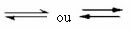
Kun suoran reaktion (tuotteen muodostumisen) kehitysnopeus on yhtä suuri kuin käänteinen reaktio (reagenssien muodostuminen) vakiolämpötilassa tarkoittaa, että reaktio on saavuttanut tasapainonsa kemiallinen.
Ja jos kyseessä on reaktio, jossa reagoivissa aineissa ja tuotteissa on vain molekyylejä, meillä on a molekyylitasapaino.Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
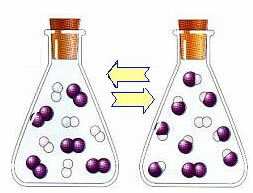
Seuraava on esimerkki reaktiosta, joka tapahtuu vetykaasun (H2) ja jodikaasua (I2), vetyjodidikaasun (HI) muodostamiseksi:
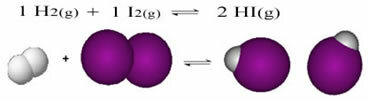
Reaktion alussa suoran reaktion kehittymisnopeus oli suurempi, kun kaikki reagoivien aineiden pitoisuudet olivat suurimmat ja tuotteiden nolla. Joten myös käänteisen reaktion kehitysnopeus oli nolla.
Ajan myötä vety- ja jodikaasut reagoivat muodostaen tuotteen. Tällä tavalla reagenssien pitoisuus alkaa laskea ja myös niiden kehitysnopeus pienenee.
Kun tuotteiden pitoisuus kasvaa ja reagenssien pitoisuus pienenee, käänteisen reaktion kehitysnopeus alkaa kasvaa. Jos lämpötila pidetään vakiona, tulee aika, jolloin nämä kaksi kehitysnopeutta pysyvät samana, mikä osoittaa, että reaktio on saavuttanut kemiallisen molekyylitasapainon.
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Molekyylitasapaino"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm. Pääsy 28. kesäkuuta 2021.