Atominumero, jota symboloi kirjain Z, vastaa tietyn kemiallisen elementin atomin ytimessä olevien protonien määrää. Esimerkiksi vedyn atomiluku on 1, mikä tarkoittaa, että sen ytimessä on vain yksi protoni.
Atomiluku näkyy yleensä kemiallisen alkuaineen alaindeksin vieressä (vasemmassa alakulmassa). Esimerkki: 1H.
Perustilassa atomiluku on yhtä suuri kuin elektronien lukumäärä, koska tässä tilassa elementti on Neutraali, siksi positiivisten varausten (protonien) määrän on oltava yhtä suuri kuin negatiivisten varausten (elektronien) määrä atomi.
Atomiluku on tärkeä, koska hän määrittää elementin tärkeimmät ominaisuudet ja ominaisuudet sekä sen käyttäytymisen ja sijainnin jaksollisessa taulukossa. Elementit on lueteltu jaksollisessa taulukossa atomiluvun nousevassa järjestyksessä, joka yleensä näkyy elementin yläpuolella, kuten alla on esitetty. Huomaa, että ensimmäinen alkuaine on vety, H (Z = 1), jota seuraa helium, He (Z = 2), sitten tulee litium, Li (Z = 3) ja niin edelleen.
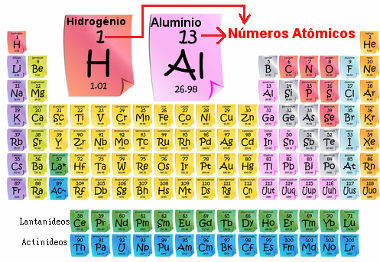
Jaksollisen järjestelmän elementtien atomimäärä
Voimme jopa käsittää kemiallisen alkion olevan "Joukko atomeja, joilla on sama atominumero". Kun siis puhumme esimerkiksi kemiallisesta alkuainehapesta, puhumme atomista, joiden atomi on numero 8. Alla on kemiallisten alkuaineiden jaksot jaksollisissa 1 ja 2 jaksollisessa taulukossa nousevassa järjestyksessä:

Kemialliset elementit jaksollisista jaksoista 1 ja 2 jaksollisessa nousevassa järjestyksessä
Alun perin atomiluvut määritteli englantilainen fyysikko Henry Gwyn Jeffreys Moseley (1887–1915), ja suoritettaessa kokeita, joihin sisältyi erilaisten elementtien pommituksia kemistien kanssa röntgensäteillä, hän havaitsi, että atomitumapäästöjen tuottaman röntgensäteilytaajuuden neliöjuuri oli suoraan verrannollinen taulukon alkuaineen atomilukuun. Määräajoin. Tällä tavoin hän päätyi siihen, että atomiluku liittyi atomien ominaisuuksiin, koska se edusti positiivisten varausten lukumäärää kunkin atomin ytimessä.
Kemialliset sidokset eivät vaikuta atomien atomien määrään, koska ne koskevat vain elektroneja, jotka ovat sähköpallossa. Ydinreaktioissa on kuitenkin mukana atomituuma, joten myös atomiluku sisältyy.
Esimerkiksi kun hiukkasia (pääasiassa kohtalaisia neutroneja) pommitetaan raskaalle, epävakaalle atomituumalle, kyseinen ydin on murtunut ja synnyttää kaksi pienempää atomituumaa, toisin sanoen pienemmällä määrällä protoneja ja neutroneja, jolloin vapautuu valtava määrä energiaa.
Ydinfuusio on toisaalta päinvastainen prosessi, se on, kun kaksi pientä ja kevyttä ydintä yhdistyvät, mikä tuottaa suuremman ja vakaamman ytimen ja vapauttaa vielä suuremman määrän energiaa.
Siten aina kun nämä ydinreaktiot tapahtuvat, syntyy uusia kemiallisia alkuaineita, koska alkuaineiden atomiluvut eroavat lopullisten alkuaineiden atomiluvuista. Katso esimerkiksi alla, että atominumerolla 92 olevan uraani-235: n hajoaminen aiheuttaa bariumia (Z = 56), kryptonia (Z = 36) ja kolmea neutronia:

Uraani-235: n ydinfissioreaktio
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-numero-atomico.htm

