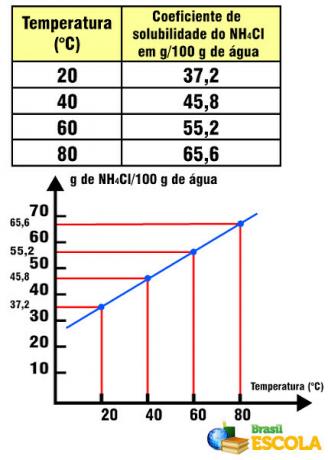
Kemiallisen reaktion järjestys on matemaattinen suhde, joka vallitsee reaktion kehittymisnopeuden tai nopeuden ja reagensseissa olevan aineen pitoisuuden välillä.
Harkitse esimerkiksi tekstissä käsiteltyä ei-alkeellista reaktiota Nopeuslaki ei-alkeisille reaktioille:
CO + NO2 → CO2 + EI
Tämän reaktion nopeuden lain antaa:
v = k. [2]2
Meillä on, että tässä tapauksessa reaktion maailmanlaajuinen järjestys on sama kuin 2, reaktion järjestys suhteessa NO-reagenssiin2 se on myös yhtä suuri kuin 2 ja reagenssin CO suhteen se on nolla.
Saavumme tähän johtopäätökseen, koska globaalin reaktion järjestys on lain reagenssipitoisuuksien eksponenttien summa. reaktion nopeuden ja järjestyksen suhteessa tiettyyn reagenssiin on sen pitoisuuden eksponentti nopeus.
Ajattele esimerkiksi, että meillä on seuraava yleinen reaktio:
aA + bB → cC + dD
Koska tämän reaktion nopeuden laki on:
v = k. [THE]α. [B]β
Sanomme, että tämä yleinen reaktio on:
- a-järjestys suhteessa A: han;
- Järjestys p B: n suhteen;
α + β = globaali reaktiojärjestys
Katso kaksi muuta esimerkkiä:
1) Perusreaktio: 2 CO(g) + O2 g)→ 2 CO2 g)
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Koska kyseessä on perusreaktio, eksponentti nopeuslaissa on yhtä suuri kuin reagenssin kerroin: v = k. [CO]2. [O2]1
Joten meillä on, että tämä reaktio on kunnossa 2 CO: n suhteen järjestys 1 suhteessa O: han2 ja sen maailmanlaajuinen järjestys on 3 (2 + 1 = 3).
2) Ei-alkuaine reaktio: 2 tuntia2 g) + 2 EI(g)→ 1 N2 g) + H2O(g)
Tämän reaktion vaiheet annetaan:
Vaihe 1 (hidas): 1 tunti2 g) + 2 EI(g) → 1 N2Og) + 2 H2O(1)
Vaihe 2 (nopea): 1 N2Og) + 2 H2O(1) → 1 N2 g) + 2 H2O(1)
Globaali yhtälö:2 tuntia2 g) + 2 EI(g) → 1 N2 g) + 2 H2O(1)
Nopeuslain eksponentit saadaan hidasvaiheen reagenssien kertoimilla: v = k [H2]1. [AT]2.
Tämä reaktio on peräisin 1ª järjestys suhteessa H: hen2, sisään 2ª järjestys suhteessa NO: han ja 3ª järjestys suhteessa globaaliin reaktioon (eksponenttien summa: 1 + 2 = 3).
Yksi MerkintäTärkeää on, että metallien pinnalla tapahtuu joitain reaktioita, jotka ovat nolla-astetta, koska nopeus ei riipu reagoivien aineiden pitoisuudesta.
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Reagoinnin järjestys"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/ordem-reacao.htm. Pääsy 27. kesäkuuta 2021.